Bank Soal Kimia SMA Reaksi Redoks
Soal
LOTS Memahami
Soal Populer Hari Ini
Dalam percobaan pengetosan dua koin, banyaknya ruang sampel yang terjadi yaitu ....
Matematika
Level 8
Statistika
Peluang
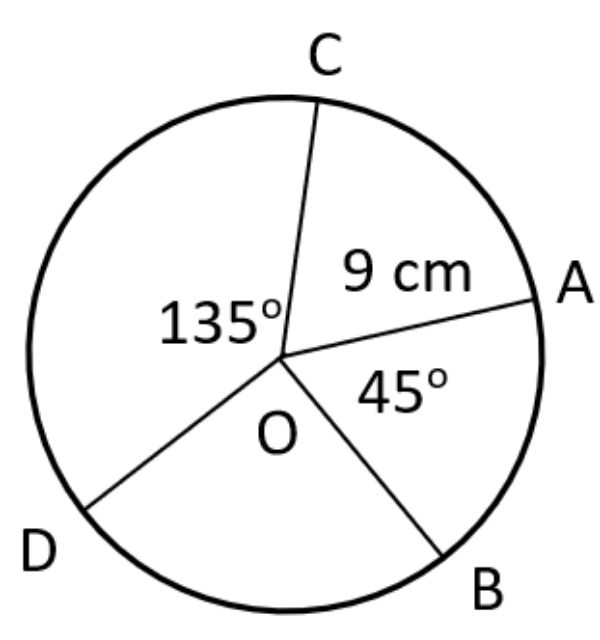
Jika panjang busur AB adalah 15 cm, maka panjang busur CD adalah ... cm
Matematika
Level 8
Geometri
Lingkaran
Luas dan Keliling Lingkaran
Perhatikan gambar berikut!
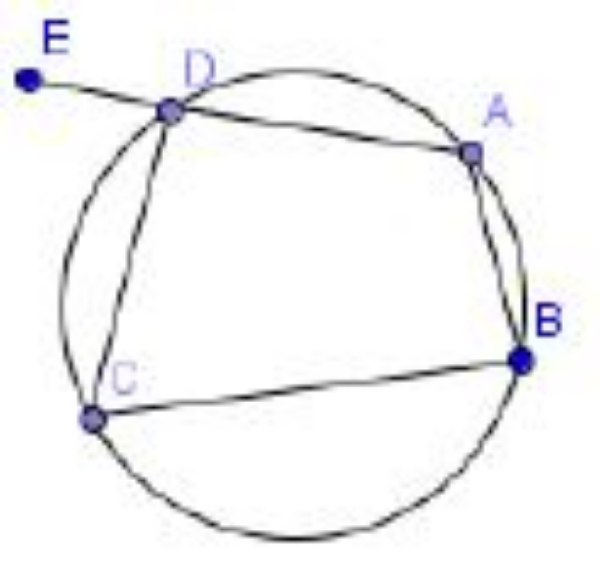
Jika sudut CDE = 75o, tentukan besar sudut ABC!
Matematika
Level 8
Geometri
Lingkaran
Suatu segitiga siku-siku PQR mempunyai luas 15 satuan luas. Jika titik P(-2, 6) dan R(-2, 1) sedangkan Q di kuadran I, maka koordinat titik Q yang mungkin adalah?
Matematika
Level 8
Geometri
Koordinat Kartesius
Cermati pilihan berikut!
- Faktual
- Non-faktual
- Berisi opini pribadi
- Berisi fakta yang bisa dibuktikan
- Bahasa yang digunakan singkat, padat, dan lugas
- Bahasa yang digunakan bertele-tele
Berdasarkan pilihan di atas, yang termasuk ciri-ciri berita adalah ....
Bahasa Indonesia
Level 8
Menulis
Teks Berita
Unsur-unsur Berita
Read the following comments of a broadway show.

Template/source: canva.com, linetv.com
Which of the following statements is true based on the comments above?
Bahasa Inggris
Level 8
Bahasa Inggris
Comparisons of people or things
Degrees of Comparison of Adverbs
Perhatikanlah gambar persegi pada koordinat cartesius berikut.

Manakah diantara titik pada koordinat cartesius yang merupakan titik pusat dari persegi?
Matematika
Level 8
Geometri
Koordinat Kartesius
Posisi Titik dan Bangun Datar
Cermati puisi berikut!
Aku
Kalau sampai waktuku
‘Ku mau tak seorang ‘kan merayu
Tidak juga kau
Tak perlu sedu sedan itu
Aku ini binatang jalang
Dari kumpulan yang terbuang
Biar peluru menembus kulitku
Aku tetap meradang menerjang
Luka dan bisa kubawa berlari
Berlari
Hingga hilang pedih peri
Dan aku akan lebih tidak peduli
Aku mau hidup seribu tahun lagi!
(Karya: Chairil Anwar)
Citraan yang terdapat pada larik yang dicetak miring tersebut adalah citraan ....
Bahasa Indonesia
Level 8
Menulis
Puisi
Unsur-unsur puisi
Kedai Minuman Rina
Rina akan membuka kedai minuman kekinian minggu depan. Ia membuat poster untuk mempromosikan kedai tersebut. Perhatikan poster kedai minuman milik Rina di bawah ini!

(Sumber Gambar: foodyas.com)
Di mana kamu bisa mendapatkan informasi lebih lanjut tentang kedai minuman milik Rina?
Bahasa Indonesia
Level 8
Menulis
Iklan, Slogan, Poster
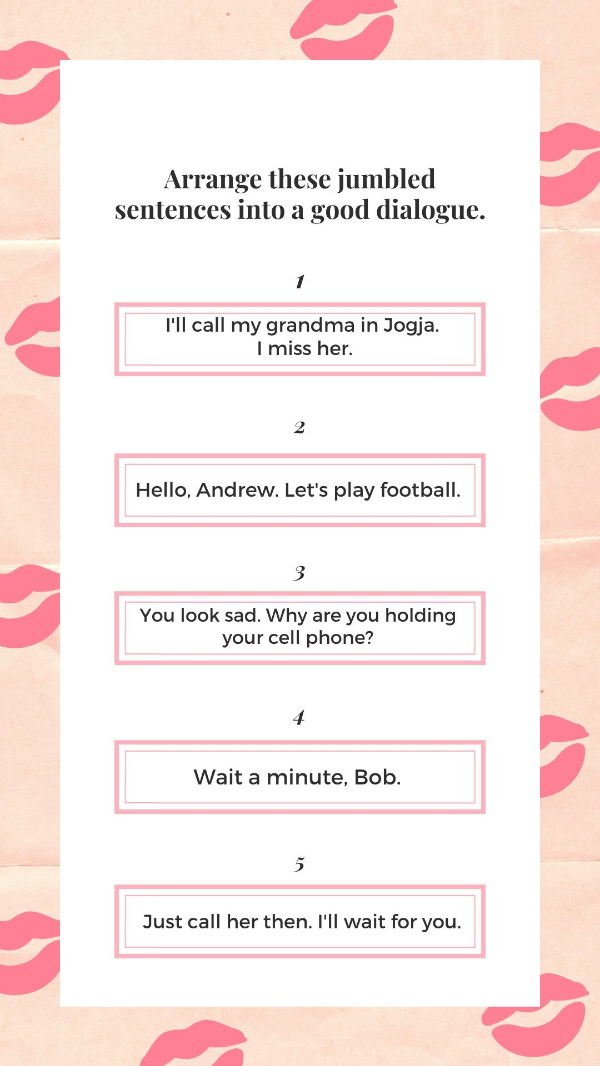
Source: canva.com
What's the best arrangement for the dialogue?
Bahasa Inggris
Level 8
Bahasa Inggris
Interaction among students inside and outside classrooms
Expressions of Willingness to Do Something
Cek Contoh Kuis Online
Kejar Kuis
Cek Contoh Bank Soal
Kejar Soal
Dalam percobaan pengetosan dua koin, banyaknya ruang sampel yang terjadi yaitu ....
Jika panjang busur AB adalah 15 cm, maka panjang busur CD adalah ... cm
Perhatikan gambar berikut!
Jika sudut CDE = 75o, tentukan besar sudut ABC!
Suatu segitiga siku-siku PQR mempunyai luas 15 satuan luas. Jika titik P(-2, 6) dan R(-2, 1) sedangkan Q di kuadran I, maka koordinat titik Q yang mungkin adalah?
Cermati pilihan berikut!
- Faktual
- Non-faktual
- Berisi opini pribadi
- Berisi fakta yang bisa dibuktikan
- Bahasa yang digunakan singkat, padat, dan lugas
- Bahasa yang digunakan bertele-tele
Berdasarkan pilihan di atas, yang termasuk ciri-ciri berita adalah ....
Read the following comments of a broadway show.
Template/source: canva.com, linetv.com
Which of the following statements is true based on the comments above?
Perhatikanlah gambar persegi pada koordinat cartesius berikut.
Manakah diantara titik pada koordinat cartesius yang merupakan titik pusat dari persegi?
Cermati puisi berikut!
Aku
Kalau sampai waktuku
‘Ku mau tak seorang ‘kan merayu
Tidak juga kau
Tak perlu sedu sedan itu
Aku ini binatang jalang
Dari kumpulan yang terbuang
Biar peluru menembus kulitku
Aku tetap meradang menerjang
Luka dan bisa kubawa berlari
Berlari
Hingga hilang pedih peri
Dan aku akan lebih tidak peduli
Aku mau hidup seribu tahun lagi!
(Karya: Chairil Anwar)
Citraan yang terdapat pada larik yang dicetak miring tersebut adalah citraan ....
Kedai Minuman Rina
Rina akan membuka kedai minuman kekinian minggu depan. Ia membuat poster untuk mempromosikan kedai tersebut. Perhatikan poster kedai minuman milik Rina di bawah ini!
(Sumber Gambar: foodyas.com)
Di mana kamu bisa mendapatkan informasi lebih lanjut tentang kedai minuman milik Rina?
Source: canva.com
What's the best arrangement for the dialogue?







