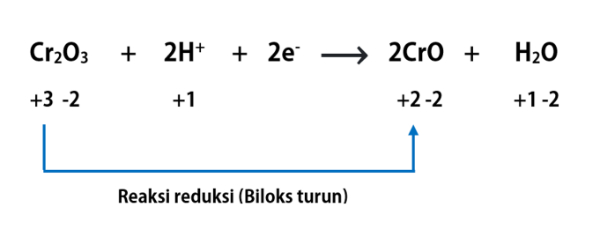
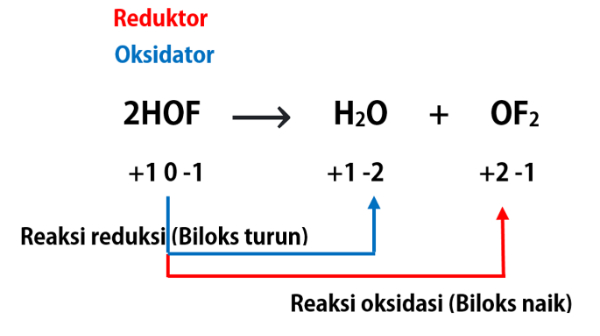
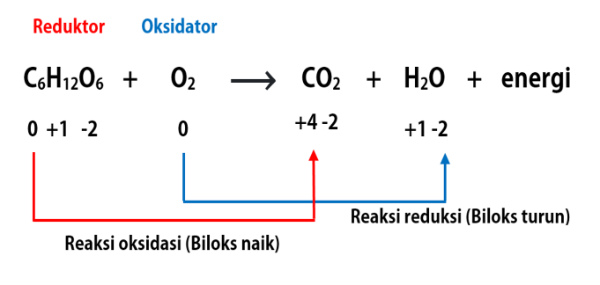
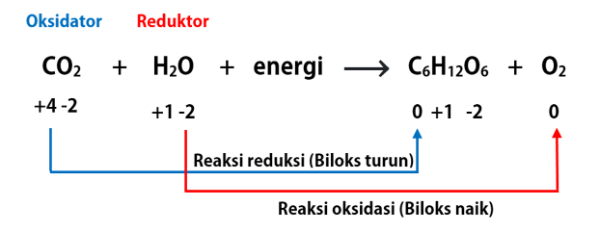
Dalam reaksi reduksi dan oksidasi terdapat beberapa istilah yaitu:
- Oksidator: senyawa yang menyebabkan senyawa lain mengalami reaksi oksidasi dan dirinya sendiri mengalami reaksi reduksi.
- Reduktor: senyawa yang menyebabkan senyawa lain mengalami reaksi reduksi dan dirinya sendiri mengalami reaksi oksidasi.
- Hasil oksidasi: senyawa hasil reaksi oksidasi yaitu berada di sisi produk dan mengandung unsur yang mengalami reaksi oksidasi/kenaikan biloks.
- Hasil reduksi: senyawa hasil reaksi reduksi yaitu berada di sisi produk dan mengandung unsur yang mengalami reaksi reduksi/penurunan biloks.
Na2S2O3
Karena Na2S2O3 tidak memiliki muatan, maka nilai penjumlahan biloks unsur penyusunnya adalah 0.
Unsur Na termasuk unsur dari golongan IA, sehingga memiliki biloks +1. Unsur O berasal dari golongan VIA, sehingga memiliki biloks -2. Dengan informasi tersebut maka biloks S dapat diketahui.
2 × Biloks Na + 2 × Biloks S + 3 × Biloks O = 0
2(+1) + 2 × Biloks S + 3(-2) = 0
+2 + 2 × Biloks S + (-6) = 0
2 × Biloks S + (-4) = 0
2 × Biloks S = +4
Biloks S = +2
Br2
Bilangan oksidasi Br pada Br2 adalah 0 sebab Br2 termasuk unsur bebas.
NaBr
Karena NaBr tidak memiliki muatan, maka nilai penjumlahan biloks unsur penyusunnya adalah 0.
Unsur Na termasuk dalam golongan IA, sehingga memiliki biloks +1.
Biloks Na + Biloks Br = 0
+1 + Biloks Br = 0
Biloks Br = -1
Na2S4O6
Karena Na2S4O6 tidak memiliki muatan, maka nilai penjumlahan biloks unsur penyusunnya adalah 0.
Unsur Na termasuk unsur dari golongan IA, sehingga memiliki biloks +1. Unsur O berasal dari golongan VIA, sehingga memiliki biloks -2. Dengan informasi tersebut maka biloks S dapat diketahui.
2 × Biloks Na + 4 × Biloks S + 6 × Biloks O = 0
2(+1) + 4 × Biloks S + 6(-2) = 0
+2 + 4 × Biloks S + (-12) = 0
4 × Biloks S + (-10) = 0
4 × Biloks S = +10
Biloks S = +2,5
Berikut disajikan gambar yang merangkum hasil dari penentuan biloks di atas.

Reduktor = Na2S2O3 = natrium tiosulfat
Oksidator = Br2 = bromin
Hasil reduksi = NaBr = natrium bromida
Hasil oksidasi = Na2S4O6 = natrium tetrationat
Dari gambar di atas dapat diketahui bahwa hasil dari oksidasi adalah Na2S4O6 dengan penamaan yang sesuai adalah natrium tetrationat.