Menurut Teori Atom Bohr, elektron-elektron mengelilingi inti pada jalur-jalur lintasan tertentu yang disebut kulit (tingkat energi). Jumlah maksimum elektron yang dapat menempati satu kulit harus memenuhi rumus 2n2 (n = nomor kulit).


Berdasarkan soal, atom memiliki 2 elektron dalam kulit pertama, 8 elektron dalam kulit kedua, 8 elektron dalam kulit ketiga dan 2 elektron dalam kulit keempat. Jika diterjemahkan dalam konfigurasi elektron Bohr makan konfigurasinya adalah sebagai berikut.
Kulit K L M N = 2 8 8 2 ⟶ Jumlah e- yang dimiliki atom dalam soal = 20.
Dari konfigurasi elektron menurut teori Bohr, kita hanya dapat mengetahui jumlah elektron pada setiap kulit. Untuk mengetahui elektron pada setiap subkulit, harus menggunakan konfigurasi elektron menurut prinsip Aufbau.
TEORI ATOM MODERN / TEORI ATOM MEKANIKA KUANTUM
Menurut Teori Atom Mekanika Kuantum (Teori Atom Modern) ternyata suatu kulit (tingkat energi) terdiri dari subkulit-subkulit (sub tingkat energi) dan suatu subkulit terdiri dari orbital.
- Subkulit s memiliki 1 orbital ⟶ maksimum ditempati 2 elektron
- Subkulit p memiliki 3 orbital ⟶ maksimum ditempati 6 elektron
- Subkulit d memiliki 5 orbital ⟶ maksimum ditempati 10 elektron
- Subkulit f memiliki 7 orbital ⟶ maksimum ditempati 14 elektron
Pengisian elektron ke dalam subkulit mengikuti prinsip Aufbau, yakni elektron-elektron mengisi subkulit mulai dari yang berenergi rendah ke subkulit yang berenergi lebih tinggi, menurut bagan sebagai berikut :
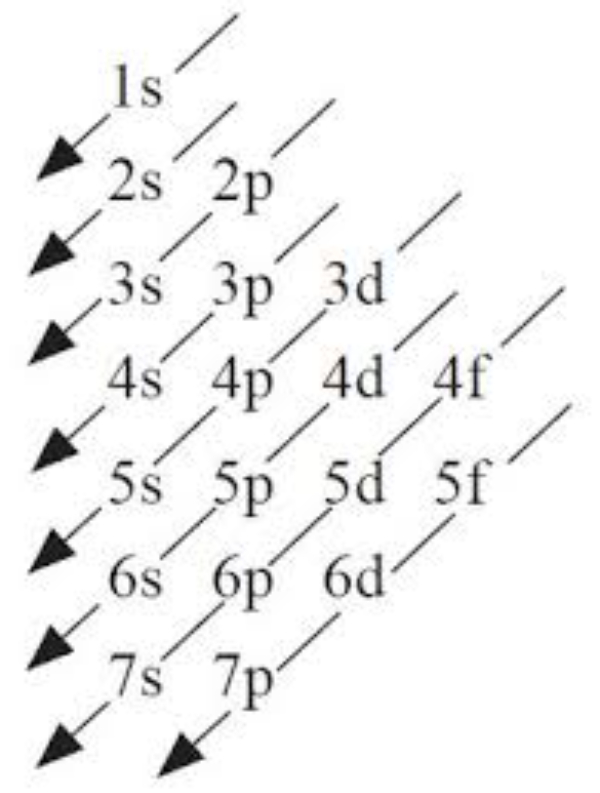
Urutan pengisian elektron menurut prinsip Aufbau:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s ...dst
Untuk mempermudah menghafal urutan pengisian elektron mengikuti prinsip Aufbau maka dapat dibuat jembatan keledainya sebagai berikut :
saya suka pisang suka pisang suka dengan pisang suka dengan pisang suka feeling donat pisang suka feeling donat pisang sekali
Huruf depan dari setiap kata merepresentasikan subkulit s, p, d dan f.
Untuk atom dengan jumlah elektron 20, konfigurasi elektron menurut prinsip Aufbau adalah
1s2 2s2 2p6 3s2 3p6 4s2
Untuk mengetahui jumlah elektron pada subkulit p, maka kita jumlahkan elektron pada setiap subkulit p.
2p6 3p6 ⟶ 6e- + 6e- = 12e-
Jadi jumlah total elektron dalam subkulit p untuk atom dalam soal adalah 12e-.





