Bank Soal Kimia SMA Nilai pH dan Prinsip Kerja Larutan Penyangga
Soal
Soal Populer Hari Ini
Hasil dari -34 + 85 - (-14) adalah ....
Matematika
Level 6
Bilangan
Operasi Hitung Bilangan Bulat dan Pecahan
Operasi Hitung Bilangan Bulat
Pay attention to the following picture.

Which vehicle travels in this place?
Bahasa Inggris
Level 6
Bahasa Inggris
Past Holidays
Vocabulary: Places for Holidays and Vehicles
Bacalah dengan seksama teks berikut!
Pertempuran Surabaya
Setelah Indonesia memproklamasikan kemerdekaannya, Indonesia belum sepenuhnya merdeka. Ada pihak-pihak yang masih belum mengakui kedaulatan Indonesia. Belanda bahkan kembali datang dengan membonceng sekutu dan berniat menjajah kembali Indonesia. Hal ini tentu mengundang berbagai reaksi dari masyarakat Indonesia.
Pada tanggal 25 Oktober 1945, tentara sekutu yang dipimpin oleh Brigadir Jendral Mallaby mendarat di Tanjung Perak, Surabaya. Kedatangan tentara sekutu diikuti oleh NICA. Mula-mula, tentara NICA melancarkan hasutan hingga menimbulkan kekacauan di Surabaya. Hal tersebut menimbulkan bentrokan antara rakyat Surabaya dengan tentara sekutu.
Kemudian pada tanggal 28–31 Oktober 1945 terjadi pertempuran yang hebat. Ketika sudah terdesak, tentara sekutu mengusulkan perdamaian. Tentara sekutu mendatangkan pemimpin-pemimpin Indonesia untuk mengadakan gencatan senjata di Surabaya. Namun, tentara sekutu tidak menghormati gencatan senjata. Dalam insiden antara rakyat Surabaya dan tentara sekutu, Brigjen Mallaby terbunuh.
Letnan Jendral Christison, panglima sekutu di Indonesia, meminta kepada pemerintah Indonesia menyerahkan orang-orang yang dicurigai membunuh Brigjen Mallaby. Permintaan tersebut diikuti ultimatum dari Mayor Jendral Mansergh yang memerintahkan rakyat Surabaya untuk menyerahkan senjatanya paling lambat tanggal 9 November 1945 pukul 18.00 WIB. Apabila ultimatum tersebut tidak dilaksanakan, kota Surabaya akan diserang dari darat, laut, dan udara.
Gubernur Suryo, diberi wewenang oleh pemerintah pusat untuk menentukan kebijaksanaannya. Beliau bermusyawarah dengan pimpinan TKR (Tentara Keamanan Rakyat) dan para pemimpin perjuangan rakyat di Surabaya. Hasil musyawarah tersebut adalah rakyat Surabaya menolak ultimatum dan siap melawan ancaman sekutu. Akibatnya, pada tanggal 10 November 1945 pukul 06.00, tentara Sekutu menggempur Surabaya dari darat, laut maupun udara. Di bawah pimpinan Gubernur Suryo dan Sutomo (Bung Tomo) rakyat Surabaya tidak mau menyerahkan sejengkal tanah pun kepada tentara sekutu. Dengan pekik “Allahu Akbar”, Bung Tomo membakar semangat rakyat. Dalam pertempuran yang berlangsung sampai awal Desember itu, gugur beribu-ribu pejuang Indonesia.
Tokoh yang memimpin dan membakar semangat rakyat Surabaya untuk berjuang melawan sekutu adalah ....
Bahasa Indonesia
Level 6
Membaca
Buku Sejarah
Menggali Informasi (5W+1H)
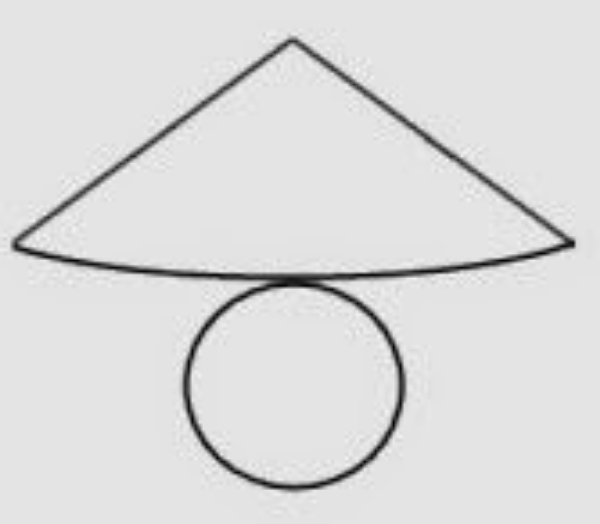
Gambar di atas merupakan jaring-jaring bangun …
Matematika
Level 6
Geometri
Bangun Ruang
Sifat dan Jaring-Jaring Bangun Ruang
Perhatikan pernyataan berikut:
- Memiliki dua sisi alas yang melengkung dan satu sisi selimut
- Sisi atas dan sisi bawah merupakan dua sisi yang saling kongruen
- Memiliki sebuah titik puncak
- Tidak memiliki rusuk
Berdasarkan pernyataan di atas yang merupakan ciri dari tabung adalah ...
Matematika
Level 6
Geometri
Bangun Ruang
Sifat dan Jaring-Jaring Bangun Ruang
Diketahui a bilangan bulat positif dan b bilangan bulat negatif.
Hasil perkalian a dan b berupa ...
Matematika
Level 6
Bilangan
Operasi Hitung Bilangan Bulat dan Pecahan
Operasi Hitung Bilangan Bulat
Berikut ini adalah kemampuan yang harus dimiliki seorang dalang, kecuali ….
Bahasa Indonesia
Level 6
Menulis
Teks Laporan Hasil Pengamatan
Menyajikan Informasi
Jika nilai a = , b = dan c = , maka hasil dari adalah ...
- Menentukan tema pidato
- Membuat kerangka pidato
- Mengembangkan kerangka menjadi naskah pidato
- Membuat pokok-pokok isi pidato
Urutan pembuatan naskah pidato yang tepat adalah ....
Bahasa Indonesia
Level 6
Membaca
Teks Pidato
Menulis Teks Pidato
Perubahan fisik yang terjadi pada manusia yang memasuki masa remaja disebut dengan ....
IPA
Level 6
Biologi
Perkembangbiakan Makhluk Hidup
Pubertas pada Manusia
Cek Contoh Kuis Online
Kejar Kuis
Cek Contoh Bank Soal
Kejar Soal
Hasil dari -34 + 85 - (-14) adalah ....
Pay attention to the following picture.

Which vehicle travels in this place?
Bacalah dengan seksama teks berikut!
Pertempuran Surabaya
Setelah Indonesia memproklamasikan kemerdekaannya, Indonesia belum sepenuhnya merdeka. Ada pihak-pihak yang masih belum mengakui kedaulatan Indonesia. Belanda bahkan kembali datang dengan membonceng sekutu dan berniat menjajah kembali Indonesia. Hal ini tentu mengundang berbagai reaksi dari masyarakat Indonesia.
Pada tanggal 25 Oktober 1945, tentara sekutu yang dipimpin oleh Brigadir Jendral Mallaby mendarat di Tanjung Perak, Surabaya. Kedatangan tentara sekutu diikuti oleh NICA. Mula-mula, tentara NICA melancarkan hasutan hingga menimbulkan kekacauan di Surabaya. Hal tersebut menimbulkan bentrokan antara rakyat Surabaya dengan tentara sekutu.
Kemudian pada tanggal 28–31 Oktober 1945 terjadi pertempuran yang hebat. Ketika sudah terdesak, tentara sekutu mengusulkan perdamaian. Tentara sekutu mendatangkan pemimpin-pemimpin Indonesia untuk mengadakan gencatan senjata di Surabaya. Namun, tentara sekutu tidak menghormati gencatan senjata. Dalam insiden antara rakyat Surabaya dan tentara sekutu, Brigjen Mallaby terbunuh.
Letnan Jendral Christison, panglima sekutu di Indonesia, meminta kepada pemerintah Indonesia menyerahkan orang-orang yang dicurigai membunuh Brigjen Mallaby. Permintaan tersebut diikuti ultimatum dari Mayor Jendral Mansergh yang memerintahkan rakyat Surabaya untuk menyerahkan senjatanya paling lambat tanggal 9 November 1945 pukul 18.00 WIB. Apabila ultimatum tersebut tidak dilaksanakan, kota Surabaya akan diserang dari darat, laut, dan udara.
Gubernur Suryo, diberi wewenang oleh pemerintah pusat untuk menentukan kebijaksanaannya. Beliau bermusyawarah dengan pimpinan TKR (Tentara Keamanan Rakyat) dan para pemimpin perjuangan rakyat di Surabaya. Hasil musyawarah tersebut adalah rakyat Surabaya menolak ultimatum dan siap melawan ancaman sekutu. Akibatnya, pada tanggal 10 November 1945 pukul 06.00, tentara Sekutu menggempur Surabaya dari darat, laut maupun udara. Di bawah pimpinan Gubernur Suryo dan Sutomo (Bung Tomo) rakyat Surabaya tidak mau menyerahkan sejengkal tanah pun kepada tentara sekutu. Dengan pekik “Allahu Akbar”, Bung Tomo membakar semangat rakyat. Dalam pertempuran yang berlangsung sampai awal Desember itu, gugur beribu-ribu pejuang Indonesia.
Tokoh yang memimpin dan membakar semangat rakyat Surabaya untuk berjuang melawan sekutu adalah ....
Gambar di atas merupakan jaring-jaring bangun …
Perhatikan pernyataan berikut:
- Memiliki dua sisi alas yang melengkung dan satu sisi selimut
- Sisi atas dan sisi bawah merupakan dua sisi yang saling kongruen
- Memiliki sebuah titik puncak
- Tidak memiliki rusuk
Berdasarkan pernyataan di atas yang merupakan ciri dari tabung adalah ...
Diketahui a bilangan bulat positif dan b bilangan bulat negatif.
Hasil perkalian a dan b berupa ...
Berikut ini adalah kemampuan yang harus dimiliki seorang dalang, kecuali ….
Jika nilai a = , b = dan c = , maka hasil dari adalah ...
- Menentukan tema pidato
- Membuat kerangka pidato
- Mengembangkan kerangka menjadi naskah pidato
- Membuat pokok-pokok isi pidato
Urutan pembuatan naskah pidato yang tepat adalah ....
Perubahan fisik yang terjadi pada manusia yang memasuki masa remaja disebut dengan ....







