Bank Soal Kimia SMA Derajat Keasaman (pH)
Soal
Soal Populer Hari Ini
Because of the significant rise in new COVID-19 in Jakarta, Luhut Binsar Pandjaitan suggests that Anies Baswedan ….
Bahasa Inggris
Level 12
Bahasa Inggris
News Item
News Item
Perhatikan tabel berikut!
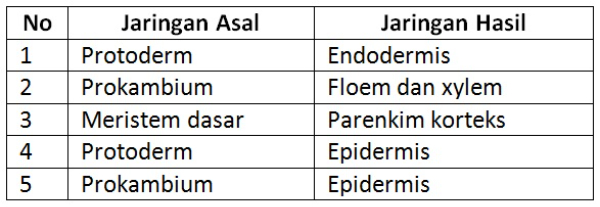
Pasangan jaringan asal dan jaringan hasil setelah terjadi perkembangan yang benar adalah nomor ....
Biologi
Level 12
Biologi
Pertumbuhan dan Perkembangan Makhluk Hidup
Pertumbuhan dan Perkembangan pada Tumbuhan
Diketahui prisma segilima beraturan . Garis yang sejajar dengan garis adalah ....
Matematika
Level 12
Geometri
Dimensi Tiga (Geometri Ruang)
Kedudukan Titik, Garis, Bidang dalam Ruang
Which of the sentence is accepting a service?
Bahasa Inggris
Level 12
Bahasa Inggris
Services
Asking for and Giving Services
Beberapa Proyek dari politik mercusuar yang terjadi pada era demokrasi terpimpin oleh Soekarno adalah ...
Sejarah Indonesia
Level 12
Kehidupan Politik dan Ekonomi Indonesia Masa Awal Kemerdekaan, Demokrasi Terpimpin, dan Demokrasi Liberal
Perkembangan Politik dan Ekonomi Indonesia (1945-1965)
Kenaikan titik didih larutan yang mengandung 5% (%m/m) glikol adalah …. (Mr = 62 ; Kb air = 0,52 °C/m).
Kimia
Level 12
Sifat Koligatif Larutan
Kenaikan Titik Didih Larutan
Perhatikan gambar di bawah ini!

Besar kuat arus listrik pada adalah ....
Fisika
Level 12
Fisika
Rangkaian Arus Searah
Rangkaian Arus Searah
Berikut ini reaksi yang dikatalisis oleh enzim sukrase adalah ....
Biologi
Level 12
Biologi
Enzim dan Metabolisme Sel
Enzim
Salah satu gerakan yang dianggap sebagai ancaman disintegrasi bangsa adalah PRRI (Pemerintahan Revolusioner Republik Indonesia), yang didirikan di wilayah ....
Sejarah Indonesia
Level 12
Upaya Bangsa Indonesia Menghadapi Ancaman Disintegrasi Bangsa
Upaya Bangsa Indonesia Mengatasi Ancaman Disintegrasi Bangsa
Nilai dari
Matematika
Level 12
Trigonometri
Limit Fungsi Trigonometri
Nilai Limit Fungsi Trigonometri
Cek Contoh Kuis Online
Kejar Kuis
Cek Contoh Bank Soal
Kejar Soal
Because of the significant rise in new COVID-19 in Jakarta, Luhut Binsar Pandjaitan suggests that Anies Baswedan ….
Perhatikan tabel berikut!
Pasangan jaringan asal dan jaringan hasil setelah terjadi perkembangan yang benar adalah nomor ....
Diketahui prisma segilima beraturan . Garis yang sejajar dengan garis adalah ....
Which of the sentence is accepting a service?
Beberapa Proyek dari politik mercusuar yang terjadi pada era demokrasi terpimpin oleh Soekarno adalah ...
Kenaikan titik didih larutan yang mengandung 5% (%m/m) glikol adalah …. (Mr = 62 ; Kb air = 0,52 °C/m).
Perhatikan gambar di bawah ini!
Besar kuat arus listrik pada adalah ....
Berikut ini reaksi yang dikatalisis oleh enzim sukrase adalah ....
Salah satu gerakan yang dianggap sebagai ancaman disintegrasi bangsa adalah PRRI (Pemerintahan Revolusioner Republik Indonesia), yang didirikan di wilayah ....
Nilai dari







