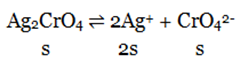Bank Soal Kimia SMA Konsep Kelarutan dan Hasil Kali Kelarutan
Soal
LOTS
Soal Populer Hari Ini
Keliling sebuah persegi panjang sama dengan keliling sebuah persegi. Lebar persegi panjang lebih pendek 8 cm daripada panjangnya. Jika sisi persegi dapat diketahui dari persamaan: 5(s + 16) = 180, di mana s adalah sisi persegi, maka pernyataan berikut yang benar adalah ...
Matematika
Level 7
Aljabar
Persamaan dan Pertidaksamaan Linear Satu Variabel
Persamaan Linear Satu Variabel (PLSV)
(i) 24816= 321616:232
(ii) 8127:93= 24327:279:81
(iii) ((-98)7)6:(-34)5(-12)= 3652
Matematika
Level 7
Bilangan
Bilangan dan Operasi Hitung Bilangan
Bilangan Berpangkat
Pak Arif, Pak Bagus, dan Pak Chiko adalah penduduk Desa Bahagia yang pekerjaannya bertani. Pak Arif menanam singkong, padi, dan kentang; Pak Bagus menanam talas, kentang, dan jagung; Pak Chiko menanam singkong dan kentang. Himpunan semua jenis tanaman penduduk Desa Bahagia yang bertani adalah …
Matematika
Level 7
Bilangan
Himpunan
Konsep dan Macam-Macam Himpunan
Hubungan dua sudut yang jika dijumlahkan hasilnya adalah 180o disebut ....
Matematika
Level 7
Geometri
Garis dan Sudut
Konsep Sudut dan Garis
Teks yang menggambarkan keadaan, bentuk atau suasana tertentu adalah ....
Bahasa Indonesia
Level 7
Menulis
Teks Deskripsi
Ciri dan Tujuan Teks Deskripsi
Hasil dari
Matematika
Level 7
Aljabar
Bentuk Aljabar
Operasi Hitung Bentuk Aljabar
Jika di dalam surat dinas ada kop surat, maka bagian yang tidak perlu dicantumkan adalah ....
Bahasa Indonesia
Level 7
Menulis
Surat Pribadi dan Surat Dinas
Unsur-unsur dan Kebahasaan Surat
Perhatikan kutipan resensi buku berikut!
Buku karya Himawan Prastists ini membantu setiap pecinta film baik pelakon maupun penonton untuk memahami film sebagai sebuah karya seni. Buku ini sekaligus memberikan contoh-contoh dari setiap unsur pembentuk film yang disertai dengan referensi dan ilustrasi film. Hal ini akan memudahkan pembaca untuk semakin terhubung dengan film. Dengan bahasa yang ringan dan bisa dibaca semua kalangan, buku ini cukup laris dan susah didapatkan bahkan di toko buku ternama. Pembelian hanya bisa dilakukan melalui situs penjual buku atau platform media sosial asli seperti instagram.
Kekurangan yang diuraikan dari resensi buku tersebut adalah ....
Bahasa Indonesia
Level 7
Menulis
Buku Fiksi dan Nonfiksi
Komentar terhadap Buku Fiksi dan Nonfiksi
Diagram batang di bawah ini menunjukkan data hasil produksi padi (ton) selama 2010 - 2014..

Selisih hasil produksi pada tahun 2014 dengan 2013 adalah ... ton.
Matematika
Level 7
Statistika
Penyajian dan Pengolahan Data
Konsep dan Pengumpulan Data
We say 'What do you do' when we want to know someone's ....
Bahasa Inggris
Level 7
Bahasa Inggris
Describing oneself
Self Introduction
Cek Contoh Kuis Online
Kejar Kuis
Cek Contoh Bank Soal
Kejar Soal
Keliling sebuah persegi panjang sama dengan keliling sebuah persegi. Lebar persegi panjang lebih pendek 8 cm daripada panjangnya. Jika sisi persegi dapat diketahui dari persamaan: 5(s + 16) = 180, di mana s adalah sisi persegi, maka pernyataan berikut yang benar adalah ...
(i) 24816= 321616:232
(ii) 8127:93= 24327:279:81
(iii) ((-98)7)6:(-34)5(-12)= 3652
Pak Arif, Pak Bagus, dan Pak Chiko adalah penduduk Desa Bahagia yang pekerjaannya bertani. Pak Arif menanam singkong, padi, dan kentang; Pak Bagus menanam talas, kentang, dan jagung; Pak Chiko menanam singkong dan kentang. Himpunan semua jenis tanaman penduduk Desa Bahagia yang bertani adalah …
Hubungan dua sudut yang jika dijumlahkan hasilnya adalah 180o disebut ....
Teks yang menggambarkan keadaan, bentuk atau suasana tertentu adalah ....
Hasil dari
Jika di dalam surat dinas ada kop surat, maka bagian yang tidak perlu dicantumkan adalah ....
Perhatikan kutipan resensi buku berikut!
Buku karya Himawan Prastists ini membantu setiap pecinta film baik pelakon maupun penonton untuk memahami film sebagai sebuah karya seni. Buku ini sekaligus memberikan contoh-contoh dari setiap unsur pembentuk film yang disertai dengan referensi dan ilustrasi film. Hal ini akan memudahkan pembaca untuk semakin terhubung dengan film. Dengan bahasa yang ringan dan bisa dibaca semua kalangan, buku ini cukup laris dan susah didapatkan bahkan di toko buku ternama. Pembelian hanya bisa dilakukan melalui situs penjual buku atau platform media sosial asli seperti instagram.
Kekurangan yang diuraikan dari resensi buku tersebut adalah ....
Diagram batang di bawah ini menunjukkan data hasil produksi padi (ton) selama 2010 - 2014..
Selisih hasil produksi pada tahun 2014 dengan 2013 adalah ... ton.
We say 'What do you do' when we want to know someone's ....