Bank Soal Kimia SMA Sel Volta dan Potensial Elektrode Standar
Soal
Memahami LOTS
Soal Populer Hari Ini
Jenis transpor aktif pada proses penyerapan kolesterol yang digunakan sebagai bahan baku pembuatan membran sel adalah ....
Biologi
Level 11
Biologi
Sel
Mekanisme Transpor Membran Plasma
Bayangan garis oleh translasi 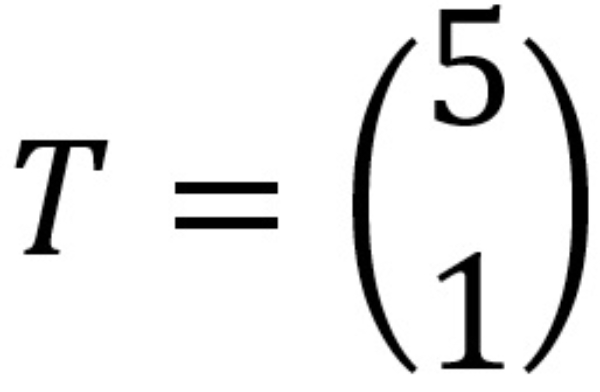 adalah ....
adalah ....
Matematika
Level 11
Geometri
Transformasi Geometri
Tranlasi
The bold sentence shows ....
Bahasa Inggris
Level 11
Good Advice
Giving Advice or Suggestions
Minyak bumi adalah hasil tambang yang sangat besar peranannya bagi perekonomian Indonesia. Minyak bumi juga merupakan pencampuran dari berbagai senyawa. Berikut ini yang merupakan penyusun utama minyak bumi adalah ....
Kimia
Level 11
Hidrokarbon dan Minyak Bumi
Hidrokarbon
Berikut ini yang merupakan contoh yang serupa dengan konsep induksi matematika adalah ....
Matematika
Level 11
Logika
Induksi Matematika
Konsep dan Prinsip Induksi Matematika
Perhatikan gambar berikut.

Poros berada di O dan titik O berada di tengah-tengah batang. Total torsi pada titik O adalah .... (; )
Fisika
Level 11
Fisika
Dinamika dan Keseimbangan Benda Tegar
Dinamika Benda Tegar
Membran sel bersifat impermeabel terhadap molekul di bawah ini, kecuali ....
Biologi
Level 11
Biologi
Sel
Mekanisme Transpor Membran Plasma
Nama senyawa dari struktur di bawah ini adalah ....
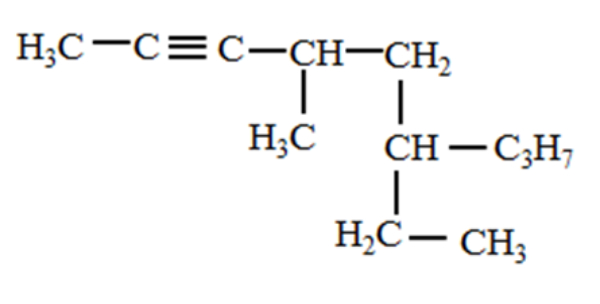
Kimia
Level 11
Hidrokarbon dan Minyak Bumi
Hidrokarbon
Nilai yang memenuhi persamaan trigonometri untuk adalah ....
Matematika
Level 11
Trigonometri
Persamaan Trigonometri
Di antara planet berikut yang merupakan planet paling panas di tata surya akibat terjadinya efek rumah kaca yang berlebihan di permukaannya adalah planet ....
Fisika
Level 11
Fisika
Pemanasan Global
Pemanasan Global dan Efek Rumah Kaca
Cek Contoh Kuis Online
Kejar Kuis
Cek Contoh Bank Soal
Kejar Soal
Jenis transpor aktif pada proses penyerapan kolesterol yang digunakan sebagai bahan baku pembuatan membran sel adalah ....
Bayangan garis oleh translasi 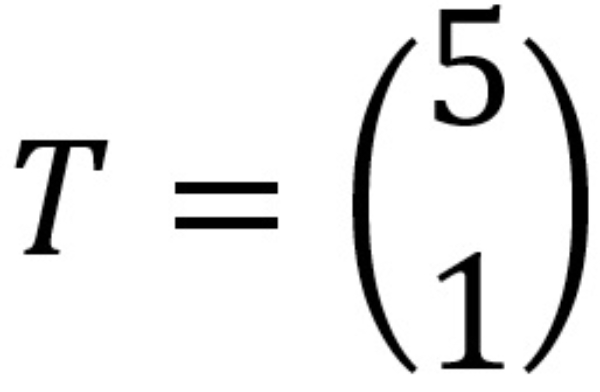
The bold sentence shows ....
Minyak bumi adalah hasil tambang yang sangat besar peranannya bagi perekonomian Indonesia. Minyak bumi juga merupakan pencampuran dari berbagai senyawa. Berikut ini yang merupakan penyusun utama minyak bumi adalah ....
Berikut ini yang merupakan contoh yang serupa dengan konsep induksi matematika adalah ....
Perhatikan gambar berikut.
Poros berada di O dan titik O berada di tengah-tengah batang. Total torsi pada titik O adalah .... (; )
Membran sel bersifat impermeabel terhadap molekul di bawah ini, kecuali ....
Nama senyawa dari struktur di bawah ini adalah ....
Nilai yang memenuhi persamaan trigonometri untuk adalah ....
Di antara planet berikut yang merupakan planet paling panas di tata surya akibat terjadinya efek rumah kaca yang berlebihan di permukaannya adalah planet ....







