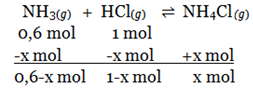Bank Soal Kimia SMA Hukum, Tetapan, dan Pergeseran Kesetimbangan
Soal
LOTS
Soal Populer Hari Ini
Change the following direct sentence into an indirect one.
The passengers asked, “When did the last train leave?”
The passengers asked ….
Bahasa Inggris
Level 12
Bahasa Inggris
News Item
Direct and Indirect Speech
Selain pertumbuhan, makhluk hidup juga mengalami proses perkembangan. Perkembangan adalah ....
Biologi
Level 12
Biologi
Pertumbuhan dan Perkembangan Makhluk Hidup
Konsep Pertumbuhan dan Perkembangan
Diketahui kubus memiliki panjang rusuk 20 cm. Titik dan masing-masing adalah titik tengah dan , sedangkan titik adalah titik potong diagonal bidang . Cosinus sudut antara dan alas adalah ....
Matematika
Level 12
Geometri
Dimensi Tiga (Geometri Ruang)
Sudut pada Bangun Ruang
Which of the following expressions is not offering services?
Bahasa Inggris
Level 12
Bahasa Inggris
Services
Asking for and Giving Services
Perhatikan poin-poin berikut.
1. Membentuk Dewan
2. Normalisasi keadaan Republik
3. Melancarkan pelaksanaan pembatalan KMB
4. Perjuangan Irian
5. Mempergiat pembangunan
Program kerja yang terdiri dari lima pasal yang dikenal dengan Panca Karya tersebut merupakan program kerja dari kabinet ....
Sejarah Indonesia
Level 12
Kehidupan Politik dan Ekonomi Indonesia Masa Awal Kemerdekaan, Demokrasi Terpimpin, dan Demokrasi Liberal
Perkembangan Politik dan Ekonomi Indonesia (1945-1965)
Sebanyak 54 gram glukosa C6H12O6 dilarutkan dalam 2 kg air. Jika diketahui Kb air = 0,52 °C/m. (Ar C = 12, H = 1, O = 16), maka kenaikan titik didih air setelah penambahan glukosa adalah ….
Kimia
Level 12
Sifat Koligatif Larutan
Kenaikan Titik Didih Larutan
Sebuah lampu pijar dengan spesifikasi 60 W pada 220 volt, dipasang pada suatu sumber potensial sebesar 110 volt. Daya yang diperlukan lampu adalah ....
Fisika
Level 12
Fisika
Rangkaian Arus Searah
Daya dan Energi Listrik
Produk akhir dari fermentasi asam laktat adalah ....
Biologi
Level 12
Biologi
Enzim dan Metabolisme Sel
Katabolisme Karbohidrat
Nilai yang memenuhi adalah ....
Matematika
Level 12
Trigonometri
Limit Fungsi Trigonometri
Nilai Limit Fungsi Trigonometri
Salah satu gerakan yang dianggap sebagai ancaman disintegrasi bangsa adalah PRRI (Pemerintahan Revolusioner Republik Indonesia), yang didirikan di wilayah ....
Sejarah Indonesia
Level 12
Upaya Bangsa Indonesia Menghadapi Ancaman Disintegrasi Bangsa
Upaya Bangsa Indonesia Mengatasi Ancaman Disintegrasi Bangsa
Cek Contoh Kuis Online
Kejar Kuis
Cek Contoh Bank Soal
Kejar Soal
Change the following direct sentence into an indirect one.
The passengers asked, “When did the last train leave?”
The passengers asked ….
Selain pertumbuhan, makhluk hidup juga mengalami proses perkembangan. Perkembangan adalah ....
Diketahui kubus memiliki panjang rusuk 20 cm. Titik dan masing-masing adalah titik tengah dan , sedangkan titik adalah titik potong diagonal bidang . Cosinus sudut antara dan alas adalah ....
Which of the following expressions is not offering services?
Perhatikan poin-poin berikut.
1. Membentuk Dewan
2. Normalisasi keadaan Republik
3. Melancarkan pelaksanaan pembatalan KMB
4. Perjuangan Irian
5. Mempergiat pembangunan
Program kerja yang terdiri dari lima pasal yang dikenal dengan Panca Karya tersebut merupakan program kerja dari kabinet ....
Sebanyak 54 gram glukosa C6H12O6 dilarutkan dalam 2 kg air. Jika diketahui Kb air = 0,52 °C/m. (Ar C = 12, H = 1, O = 16), maka kenaikan titik didih air setelah penambahan glukosa adalah ….
Sebuah lampu pijar dengan spesifikasi 60 W pada 220 volt, dipasang pada suatu sumber potensial sebesar 110 volt. Daya yang diperlukan lampu adalah ....
Produk akhir dari fermentasi asam laktat adalah ....
Nilai yang memenuhi adalah ....
Salah satu gerakan yang dianggap sebagai ancaman disintegrasi bangsa adalah PRRI (Pemerintahan Revolusioner Republik Indonesia), yang didirikan di wilayah ....