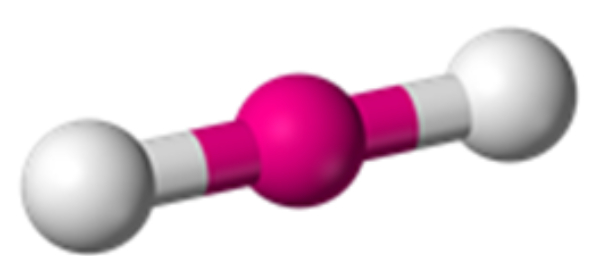
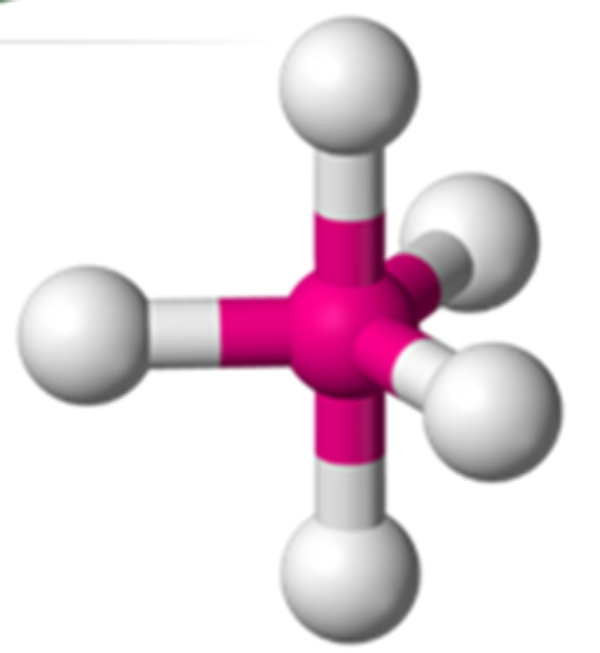
Bank Soal Kimia SMA Memprediksi Bentuk Molekul
Soal
Mengaplikasikan LOTS
Soal Populer Hari Ini
Perhatikan tabel berikut!
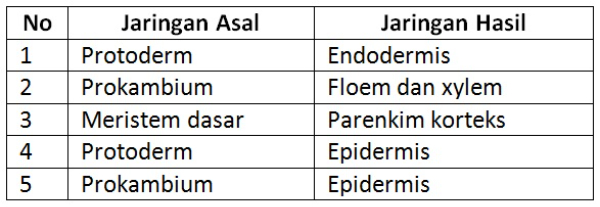
Pasangan jaringan asal dan jaringan hasil setelah terjadi perkembangan yang benar adalah nomor ....
Biologi
Level 12
Biologi
Pertumbuhan dan Perkembangan Makhluk Hidup
Pertumbuhan dan Perkembangan pada Tumbuhan
Kelas XII
Kurikulum 2013
K13
What is the news about?
Bahasa Inggris
Level 12
Bahasa Inggris
News Item
News Item
Kelas XII
Kurikulum 2013
K13
Perhatikan poin-poin berikut.1
- Membentuk Dewan
- Normalisasi keadaan Republik
- Melancarkan pelaksanaan pembatalan KMB
- Perjuangan Irian
- Mempergiat pembangunan
Program kerja yang terdiri dari lima pasal yang dikenal dengan Panca Karya tersebut merupakan program kerja dari kabinet....
Sejarah Indonesia
Level 12
Kehidupan Politik dan Ekonomi Indonesia Masa Awal Kemerdekaan, Demokrasi Terpimpin, dan Demokrasi Liberal
Perkembangan Politik dan Ekonomi Indonesia (1945-1965)
Kelas XII
Kurikulum 2013
K13
Sejarah Indonesia


Bree wants her little brother to get home safely. She offers to drive him home. What will she say to him?
Bahasa Inggris
Level 12
Bahasa Inggris
Services
Modals
Kelas XII
Kurikulum 2013
K13
Berikut ini yang bukan merupakan kedudukan garis dan bidang dalam ruang adalah ....
Matematika
Level 12
Geometri
Dimensi Tiga (Geometri Ruang)
Kedudukan Titik, Garis, Bidang dalam Ruang
Kelas XII
Kurikulum 2013
K13
Matematika Wajib
Perhatikan gambar dua rangkaian di bawah ini.
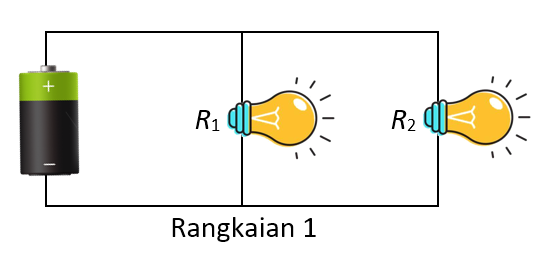
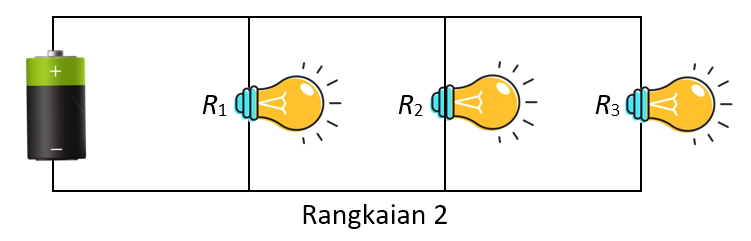
Diketahui bahwa arus listrik pada rangkaian 1 adalah A sedangkan arus listrik pada rangkaian 2 adalah B, dan tegangan jepit baterai rangkaian 1 adalah C, sedangkan tegangan jepit baterai rangkaian 2 adalah D. Jika baterai rangkaian 1 dan 2 adalah sama, maka pernyataan yang benar adalah ....
Fisika
Level 12
Fisika
Rangkaian Arus Searah
Rangkaian Arus Searah
Kelas XII
Kurikulum 2013
K13
Banyaknya urea (Mr = 60) yang harus dilarutkan dalam 500 mL larutan sehingga isotonik dengan larutan KCl 0,2 M adalah ….
Kimia
Level 12
Sifat Koligatif Larutan
Sifat Koligatif Larutan Elektrolit
Kelas XII
Kurikulum 2013
K13
Kimia
Produk akhir dari fermentasi asam laktat adalah ....
Biologi
Level 12
Biologi
Enzim dan Metabolisme Sel
Katabolisme Karbohidrat
Kelas XII
Kurikulum 2013
K13
Nilai
Matematika
Level 12
Trigonometri
Limit Fungsi Trigonometri
Kelas XII
Kurikulum 2013
K13
Matematika Peminatan
George sedang bermain bola di lapangan sekolah, tanpa sengaja kawannya menendang bola terlalu keras hingga menghantam wajah George. Hidung George mengalami pendarahan dan tidak mau berhenti walaupun sudah dilakukan pertolongan pertama. Guru dan kawan-kawannya segera membawa George ke rumah sakit dikarenakan keadaan George semakin memburuk. Setelah menjalani pengobatan, dokter menanyakan riwayat keluarga George ternyata di keluarga mereka ada gen darah sulit membeku.
Berikut ini riwayat yang mungkin dalam keluarga George.
1) Ibu George pasti seorang carrier hemofilia.
2) Ayah George pasti seorang penderita hemofilia.
3) Gen hemofilia George diwariskan dari ibunya.
4) Gen hemofilia George bisa diwariskan dari ayah atau ibunya.
Jika diagonasa dokter menunjukkan bahwa George penderita hemofilia, maka pernyataan yang tepat adalah nomor ....
Biologi
Level 12
Biologi
Hereditas pada Manusia
Variasi Sifat dan Peta Silsilah Keluarga (Pedigree)
Kelas XII
Kurikulum 2013
K13
Cek Contoh Kuis Online
Kejar Kuis
Cek Contoh Bank Soal
Kejar Soal
Perhatikan tabel berikut!
Pasangan jaringan asal dan jaringan hasil setelah terjadi perkembangan yang benar adalah nomor ....
What is the news about?
Perhatikan poin-poin berikut.1
- Membentuk Dewan
- Normalisasi keadaan Republik
- Melancarkan pelaksanaan pembatalan KMB
- Perjuangan Irian
- Mempergiat pembangunan
Program kerja yang terdiri dari lima pasal yang dikenal dengan Panca Karya tersebut merupakan program kerja dari kabinet....
Bree wants her little brother to get home safely. She offers to drive him home. What will she say to him?
Berikut ini yang bukan merupakan kedudukan garis dan bidang dalam ruang adalah ....
Perhatikan gambar dua rangkaian di bawah ini.
Diketahui bahwa arus listrik pada rangkaian 1 adalah A sedangkan arus listrik pada rangkaian 2 adalah B, dan tegangan jepit baterai rangkaian 1 adalah C, sedangkan tegangan jepit baterai rangkaian 2 adalah D. Jika baterai rangkaian 1 dan 2 adalah sama, maka pernyataan yang benar adalah ....
Banyaknya urea (Mr = 60) yang harus dilarutkan dalam 500 mL larutan sehingga isotonik dengan larutan KCl 0,2 M adalah ….
Produk akhir dari fermentasi asam laktat adalah ....
Nilai
George sedang bermain bola di lapangan sekolah, tanpa sengaja kawannya menendang bola terlalu keras hingga menghantam wajah George. Hidung George mengalami pendarahan dan tidak mau berhenti walaupun sudah dilakukan pertolongan pertama. Guru dan kawan-kawannya segera membawa George ke rumah sakit dikarenakan keadaan George semakin memburuk. Setelah menjalani pengobatan, dokter menanyakan riwayat keluarga George ternyata di keluarga mereka ada gen darah sulit membeku.
Berikut ini riwayat yang mungkin dalam keluarga George.
1) Ibu George pasti seorang carrier hemofilia.
2) Ayah George pasti seorang penderita hemofilia.
3) Gen hemofilia George diwariskan dari ibunya.
4) Gen hemofilia George bisa diwariskan dari ayah atau ibunya.
Jika diagonasa dokter menunjukkan bahwa George penderita hemofilia, maka pernyataan yang tepat adalah nomor ....