Bank Soal Kimia SMA Sifat Koligatif Larutan Elektrolit
Soal
LOTS Memahami
Soal Populer Hari Ini
Sebuah supermarket mengadakan undian berhadiah untuk konsumennya.
Setiap konsumen dapat menukarkan kupon undian yang terkumpul untuk ditukar dengan hadiah.
Ketentuan kupon yang dapat ditukar dengan hadiah seperti gambar berikut.

(Sumber gambar: freepik.com)
Hadiah yang diperoleh untuk pengumpulan kupon yang paling sedikit menurut gambar di atas adalah ....
Matematika
Level 3
Bilangan
Bilangan Cacah dan Pecahan Sederhana
Membandingkan dan Mengurutkan Bilangan Cacah
Perhatikan gambar berikut.

Kalimat yang sesuai dengan gambar adalah …
Bahasa Indonesia
Level 3
Menulis
Informasi tentang Konsep
Menulis Kalimat Sesuai Gambar
Perhatikan diagram gambar jumlah pasien yang datang ke suatu klinik dalam 5 hari berikut.
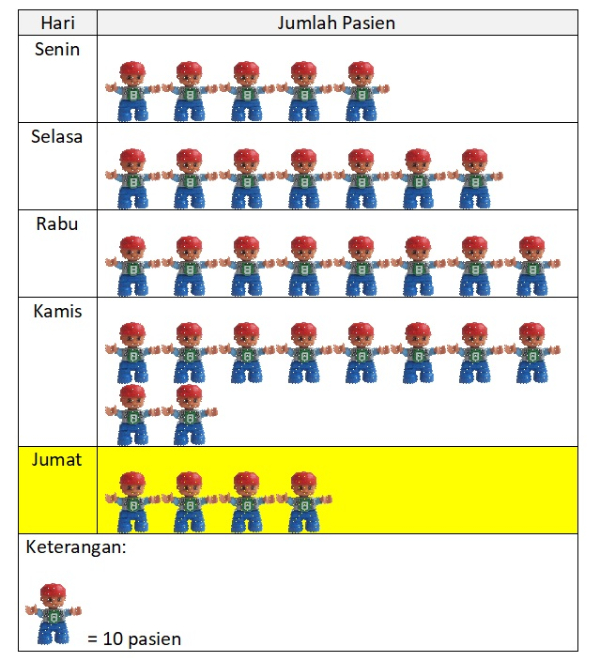
Berapakah banyak pasien yang datang ke klinik pada hari Jumat?
Matematika
Level 3
Statistika
Data
Membaca dan Menafsirkan Data
Perhatikan denah berikut!
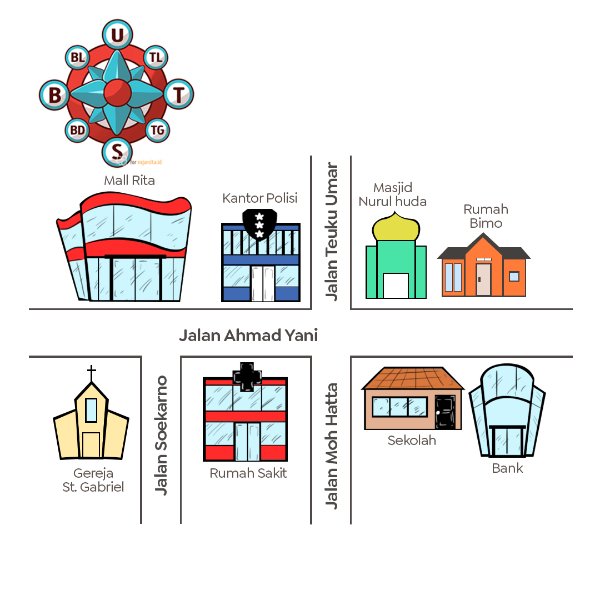
Jika Bimo ingin ke mall Rita dari rumahnya, maka ia bisa melewati ....
Bahasa Indonesia
Level 3
Menulis
Informasi Delapan Mata Angin
Membaca Denah
Nilai dari
 adalah ....
adalah ....
Matematika
Level 3
Bilangan
Pecahan Sederhana
Penjumlahan Pecahan Penyebut Sama
Perhatikan gambar berikut!

(Sumber: freepik.com)
Alat di atas digunakan untuk mengukur ....
Matematika
Level 3
Geometri
Pengukuran Waktu, Panjang, Berat
Alat Ukur Berat
Ovie membuat jus jeruk dengan blender.
Jus jeruk yang ada di dalam blender akan dibagikan ke beberapa gelas.
Volume jus jeruk dalam blender setara dengan 4 satuan gelas.
Gambaran yang sesuai adalah ....
Matematika
Level 3
Geometri
Volume Bangun Ruang
Konsep Volume
Berikut yang bukan merupakan jenis sudut adalah ....
Matematika
Level 3
Geometri
Bangun Datar
Jenis dan Besar Sudut

Sumber: freepik.com
SD Matahari akan mengadakan piknik ke Candi Borobudur dengan 9 bus.
Setiap bus berisi 24 siswa.
Banyak siswa yang mengikuti kegiatan piknik ke Candi Borobudur adalah ....
Matematika
Level 3
Bilangan
Operasi Hitung Bilangan Cacah
Operasi Hitung Bilangan Cacah
Kita menyusun daftar pertanyaan wawancara ketika ....
Bahasa Indonesia
Level 3
Menulis
Wawancara
Menggali Informasi melalui Wawancara
Cek Contoh Kuis Online
Kejar Kuis
Cek Contoh Bank Soal
Kejar Soal
Sebuah supermarket mengadakan undian berhadiah untuk konsumennya.
Setiap konsumen dapat menukarkan kupon undian yang terkumpul untuk ditukar dengan hadiah.
Ketentuan kupon yang dapat ditukar dengan hadiah seperti gambar berikut.
(Sumber gambar: freepik.com)
Hadiah yang diperoleh untuk pengumpulan kupon yang paling sedikit menurut gambar di atas adalah ....
Perhatikan gambar berikut.
Kalimat yang sesuai dengan gambar adalah …
Perhatikan diagram gambar jumlah pasien yang datang ke suatu klinik dalam 5 hari berikut.
Berapakah banyak pasien yang datang ke klinik pada hari Jumat?
Perhatikan denah berikut!
Jika Bimo ingin ke mall Rita dari rumahnya, maka ia bisa melewati ....
Nilai dari
adalah ....
Perhatikan gambar berikut!
(Sumber: freepik.com)
Alat di atas digunakan untuk mengukur ....
Ovie membuat jus jeruk dengan blender.
Jus jeruk yang ada di dalam blender akan dibagikan ke beberapa gelas.
Volume jus jeruk dalam blender setara dengan 4 satuan gelas.
Gambaran yang sesuai adalah ....
Berikut yang bukan merupakan jenis sudut adalah ....
Sumber: freepik.com
SD Matahari akan mengadakan piknik ke Candi Borobudur dengan 9 bus.
Setiap bus berisi 24 siswa.
Banyak siswa yang mengikuti kegiatan piknik ke Candi Borobudur adalah ....
Kita menyusun daftar pertanyaan wawancara ketika ....







