Bank Soal Kimia SMA Konsep Kelarutan dan Hasil Kali Kelarutan
Soal
Soal Populer Hari Ini
Berapakah pecahan yang digambarkan dalam diagram ini?

Matematika
Level 4
Bilangan
Pecahan
Pecahan Senilai
Rumus luas jajar genjang yaitu …
Matematika
Level 5,6
Geometri
Bangun Datar
Ulasan: Mata di Tanah Melus oleh Okky Madasari
Ayo ikuti petualangan ajaib Mata dengan bangsa punah Melus! Begitu kira-kira ajakan seri pertama dari novel Mata ini. Mata adalah anak perempuan berusia dua belas tahun asal Jakarta. Suatu hari orang tuanya bertengkar dan ia dibawa ibunya ke Belu, NTT. Celakanya, Mata terpisah dari ibunya. Ia tersesat di kediaman suku Melus yang konon punah tapi ternyata masih hidup di tempat rahasia. Maka mulailah pertemuan Mata dengan hal-hal ajaib, seperti Bei Nai, Dewa Buaya pelindung Melus, dan Ratu Kupu-Kupu, seorang manusia dengan sayap indah. Tidak hanya itu, Mata juga berkunjung ke masa lalu, abad ke-15-17, ketika kapal-kapal negara Eropa mulai berdatangan ke tanah ini.

Sampul novel Mata di Tanah Melus oleh Okky Madasari
Tidak hanya menggugah khayalan, novel ini juga mengandung pelajaran ilmiah. Pelajaran-pelajaran ini dibungkus oleh hal-hal ajaib dalam cerita mulai dari makhluk-makhluk gaib, perjalanan ke masa lalu, hingga makanan terlezat dari bahan tanaman. Namun sebenarnya di balik keajaiban itu, terkandung ilmu geografi (lokasi Belu, NTT), sejarah (peradaban Melus di abad lampau), dan antropologi (legenda, adat istiadat masyarakat Melus). Ini karena penulis novel benar-benar menggunakan informasi yang didapatnya ketika melakukan penelitian di Belu, NTT.
(Sumber: goodreads.com)
Berdasarkan ulasan buku sastra anak di atas, alasan Mata mengunjungi Belu, NTT adalah ....
Bahasa Indonesia
Level 4
Membaca
Buku Sastra
Ulasan Buku Sastra

Source: freepik.com
Put the words in the correct order to make a good sentence.
chef / is / a / she
The correct order is ...
Bahasa Inggris
Level 4
Bahasa Inggris
Jobs
Simple Present Tense
Bilangan kelipatan 3 yang lebih dari 10 dan habis dibagi 5 adalah ...
Matematika
Level 4
Bilangan
Faktor dan Kelipatan
Kelipatan Bilangan
Jumlah sisi Segitiga + Jumlah sisi Segi Empat adalah ...
Matematika
Level 4
Geometri
Bangun Datar
Segi Banyak
Di sebuah mall terpasang lampu hias. Lampu biru menyala setiap 12 detik, kemudian padam. Lampu merah menyala setiap 16 detik kemudian padam. Lampu kuning menyala setiap 18 detik kemudian padam. maka ketiga lampu akan menyala secara bersamaan pada detik ke ...
Matematika
Level 4
Bilangan
FPB dan KPK
KPK
Cermati teks berikut!
Jaka Tarub

Suatu malam, Jaka Tarub bermimpi makan daging rusa yang lezat. Paginya Jaka Tarub pergi ke hutan untuk berburu rusa. Alih-alih rusa, yang ditemukan malah tujuh bidadari cantik yang sedang mandi di telaga. Dengan mengendap-endap, Jaka Tarub mengambil salah satu selendang bidadari yang ada di pinggir telaga. Karena tidak dapat pulang ke kahyangan tanpa selendangnya, Nawang Wulan terpaksa ditinggal oleh kakak-kakaknya.
Nawang Wulan yang bersedih hati karena ditinggal pun bersedia ikut Jaka Tarub pulang ke rumahnya. Tak lama kemudian, mereka pun menikah. Anak perempuan pertama mereka, Nawangsih, terlahir setelahnya. Sejak adanya Nawang Wulan dan Nawangsih, Jaka Tarub merasa hidupnya bahagia kembali.
Sejak pernikahannya dengan Nawang Wulan, Jaka Tarub merasakan adanya satu keanehan. Hal ini yaitu lumbung padinya tidak pernah berkurang meskipun selalu diambil berasnya untuk memasak nasi. Meski diminta berjanji untuk tidak mencari tahu, Jaka Tarub melanggar janjinya sendiri dengan mengintip periuk nasi yang sedang dimasak Nawang Wulan. Akibatnya, kekuatan Nawang Wulan pun hilang. Sejak itu ia harus menumbuk dan menampi beras seperti manusia lainnya. Akibatnya lumbung padi Jaka Tarub terus berkurang.
Suatu hari Nawang Wulan menemukan selendangnya yang sudah lama hilang di dalam lumbung. Nawang Wulan lalu memutuskan kembali ke kahyangan dengan selendangnya. Sebelum berangkat ke kahyangan, Nawang Wulan berpesan pada Jaka Tarub untuk meninggalkan Nawangsih di dekat rumahnya tiap malam. Setiap malam Nawang Wulan turun menghampiri Nawangsih dan kembali ke kahyangan menjelang pagi. Demikian hal ini terus berlanjut hingga Nawangsih beranjak dewasa. Setelahnya, Nawang Wulan tidak pernah lagi turun ke bumi dan Jaka Tarub tidak pernah bertemu dengannya lagi.
Tokoh utama dari cerita di atas adalah ....
Bahasa Indonesia
Level 4
Membaca
Teks Fiksi-Tokoh Cerita
Cerita Rakyat
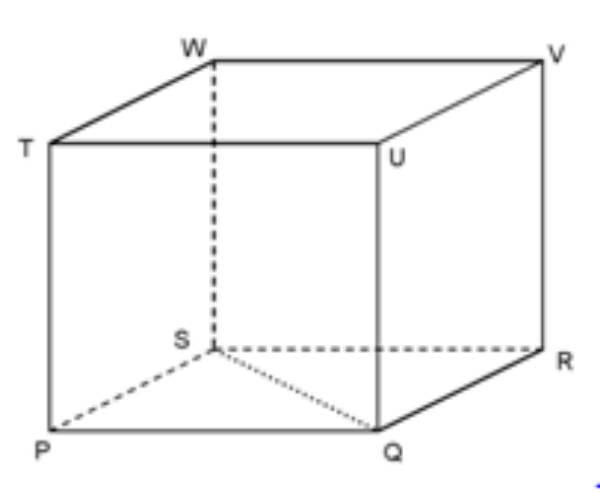
Pada kubus PQRS.TUVW, tentukan kedudukan garis RT dan SU!
Matematika
Level 4
Geometri
Garis dan Sudut
Hubungan Antar Garis
Perhatikan tabel berikut.

Kelas manakah yang mempunyai jumlah murid paling sedikit?
Matematika
Level 4
Statistika
Bentuk Diagram
Membaca Diagram
Cek Contoh Kuis Online
Kejar Kuis
Cek Contoh Bank Soal
Kejar Soal
Berapakah pecahan yang digambarkan dalam diagram ini?
Rumus luas jajar genjang yaitu …
Ulasan: Mata di Tanah Melus oleh Okky Madasari
Ayo ikuti petualangan ajaib Mata dengan bangsa punah Melus! Begitu kira-kira ajakan seri pertama dari novel Mata ini. Mata adalah anak perempuan berusia dua belas tahun asal Jakarta. Suatu hari orang tuanya bertengkar dan ia dibawa ibunya ke Belu, NTT. Celakanya, Mata terpisah dari ibunya. Ia tersesat di kediaman suku Melus yang konon punah tapi ternyata masih hidup di tempat rahasia. Maka mulailah pertemuan Mata dengan hal-hal ajaib, seperti Bei Nai, Dewa Buaya pelindung Melus, dan Ratu Kupu-Kupu, seorang manusia dengan sayap indah. Tidak hanya itu, Mata juga berkunjung ke masa lalu, abad ke-15-17, ketika kapal-kapal negara Eropa mulai berdatangan ke tanah ini.
Sampul novel Mata di Tanah Melus oleh Okky Madasari
Tidak hanya menggugah khayalan, novel ini juga mengandung pelajaran ilmiah. Pelajaran-pelajaran ini dibungkus oleh hal-hal ajaib dalam cerita mulai dari makhluk-makhluk gaib, perjalanan ke masa lalu, hingga makanan terlezat dari bahan tanaman. Namun sebenarnya di balik keajaiban itu, terkandung ilmu geografi (lokasi Belu, NTT), sejarah (peradaban Melus di abad lampau), dan antropologi (legenda, adat istiadat masyarakat Melus). Ini karena penulis novel benar-benar menggunakan informasi yang didapatnya ketika melakukan penelitian di Belu, NTT.
(Sumber: goodreads.com)
Berdasarkan ulasan buku sastra anak di atas, alasan Mata mengunjungi Belu, NTT adalah ....
Source: freepik.com
Put the words in the correct order to make a good sentence.
chef / is / a / she
The correct order is ...
Bilangan kelipatan 3 yang lebih dari 10 dan habis dibagi 5 adalah ...
Jumlah sisi Segitiga + Jumlah sisi Segi Empat adalah ...
Di sebuah mall terpasang lampu hias. Lampu biru menyala setiap 12 detik, kemudian padam. Lampu merah menyala setiap 16 detik kemudian padam. Lampu kuning menyala setiap 18 detik kemudian padam. maka ketiga lampu akan menyala secara bersamaan pada detik ke ...
Cermati teks berikut!
Jaka Tarub
Suatu malam, Jaka Tarub bermimpi makan daging rusa yang lezat. Paginya Jaka Tarub pergi ke hutan untuk berburu rusa. Alih-alih rusa, yang ditemukan malah tujuh bidadari cantik yang sedang mandi di telaga. Dengan mengendap-endap, Jaka Tarub mengambil salah satu selendang bidadari yang ada di pinggir telaga. Karena tidak dapat pulang ke kahyangan tanpa selendangnya, Nawang Wulan terpaksa ditinggal oleh kakak-kakaknya.
Nawang Wulan yang bersedih hati karena ditinggal pun bersedia ikut Jaka Tarub pulang ke rumahnya. Tak lama kemudian, mereka pun menikah. Anak perempuan pertama mereka, Nawangsih, terlahir setelahnya. Sejak adanya Nawang Wulan dan Nawangsih, Jaka Tarub merasa hidupnya bahagia kembali.
Sejak pernikahannya dengan Nawang Wulan, Jaka Tarub merasakan adanya satu keanehan. Hal ini yaitu lumbung padinya tidak pernah berkurang meskipun selalu diambil berasnya untuk memasak nasi. Meski diminta berjanji untuk tidak mencari tahu, Jaka Tarub melanggar janjinya sendiri dengan mengintip periuk nasi yang sedang dimasak Nawang Wulan. Akibatnya, kekuatan Nawang Wulan pun hilang. Sejak itu ia harus menumbuk dan menampi beras seperti manusia lainnya. Akibatnya lumbung padi Jaka Tarub terus berkurang.
Suatu hari Nawang Wulan menemukan selendangnya yang sudah lama hilang di dalam lumbung. Nawang Wulan lalu memutuskan kembali ke kahyangan dengan selendangnya. Sebelum berangkat ke kahyangan, Nawang Wulan berpesan pada Jaka Tarub untuk meninggalkan Nawangsih di dekat rumahnya tiap malam. Setiap malam Nawang Wulan turun menghampiri Nawangsih dan kembali ke kahyangan menjelang pagi. Demikian hal ini terus berlanjut hingga Nawangsih beranjak dewasa. Setelahnya, Nawang Wulan tidak pernah lagi turun ke bumi dan Jaka Tarub tidak pernah bertemu dengannya lagi.
Tokoh utama dari cerita di atas adalah ....
Pada kubus PQRS.TUVW, tentukan kedudukan garis RT dan SU!
Perhatikan tabel berikut.
Kelas manakah yang mempunyai jumlah murid paling sedikit?







