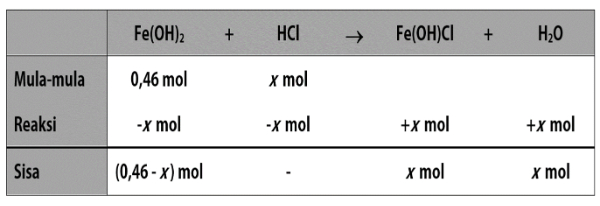
Bank Soal Kimia SMA Nilai pH dan Prinsip Kerja Larutan Penyangga
Soal
LOTS
Soal Populer Hari Ini
Keliling sebuah persegi panjang sama dengan keliling sebuah persegi. Lebar persegi panjang lebih pendek 8 cm daripada panjangnya. Jika sisi persegi dapat diketahui dari persamaan: 5(s + 16) = 180, di mana s adalah sisi persegi, maka pernyataan berikut yang benar adalah ...
Matematika
Level 7
Aljabar
Persamaan dan Pertidaksamaan Linear Satu Variabel
Persamaan Linear Satu Variabel (PLSV)
-34 : (32)0 + 27 = ...
Matematika
Level 7
Bilangan
Bilangan dan Operasi Hitung Bilangan
Bilangan Berpangkat



Perhatikan gambar di atas. Gambar itu disebut …
Matematika
Level 7
Bilangan
Himpunan
Konsep dan Macam-Macam Himpunan
Perhatikan gambar berikut!
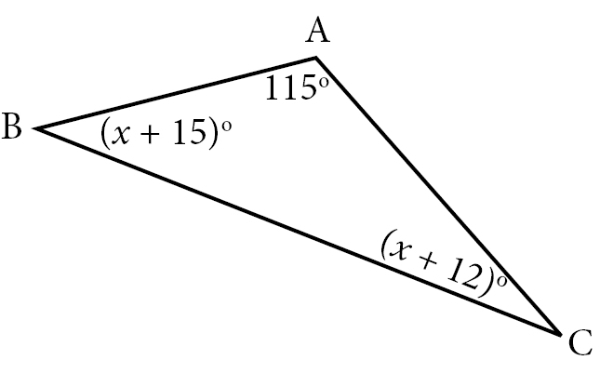
Besar sudut ABC adalah ....
Matematika
Level 7
Geometri
Garis dan Sudut
Hubungan Antar Sudut
Penulisan teks deskripsi yang sesuai dengan struktur dan kaidah bahasa yang benar adalah ...
Bahasa Indonesia
Level 7
Menulis
Teks Deskripsi
Struktur dan Kebahasaan Teks Deskripsi
Cermati kutipan surat berikut ini.

Berdasarkan isi surat di atas, sifat si pengirim dulu waktu di sekolah adalah ....
Bahasa Indonesia
Level 7
Menulis
Surat Pribadi dan Surat Dinas
Simpulan Isi Surat Pribadi dan Surat Dinas
Hasil dari:
Matematika
Level 7
Aljabar
Bentuk Aljabar
Operasi Hitung Bentuk Aljabar
Perhatikan biografi berikut!

(Sumber gambar: akurat.co)
Salah satu penyanyi Indonesia yang pernah berduet dengan banyak penyanyi kenamaan Indonesia adalah Iwan Fals. Beliau pernah membawakan lagu berjudul Percayalah Kasih bersama Jockie Surjoprajogo dan Vina Panduwinata. Penyanyi dengan nama asli Virgiawan Lisanto ini merupakan salah satu legenda di Indonesia. Gaya musik yang dibawakannya adalah pop, rock, country, hingga folk pop. Lirik dari lagu-lagu Iwan Fals banyak menceritakan masa-masa kelam era 1970 hingga 1980-an di bidang politik. Salah satu lagunya bersama Swarmi yang berjudul Bongkar menerima penghargaan 150 lagu terbaik sepanjang masa versi Majalah Rolling Stone peringkat 1.
(Dikutip dari berbagai sumber)
Di bawah ini merupakan gaya musik yang dibawakan oleh Iwan Fals, kecuali ….
Bahasa Indonesia
Level 7
Menulis
Buku Fiksi dan Nonfiksi
Unsur Pembangun Buku Fiksi dan Nonfiksi
Diagram lingkaran di bawah ini menunjukkan sumber air minum yang dikonsumsi oleh penduduk di Jawa Tengah tahun 2020.
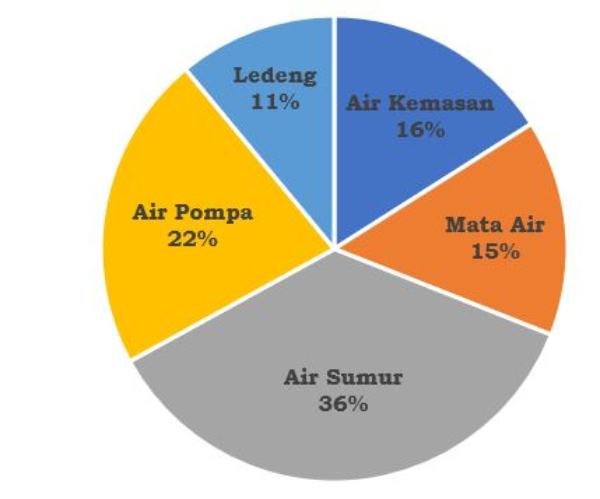
Jika jumlah seluruh penduduk tersebut adalah 34.000.000 orang, maka jumlah penduduk yang mengonsumsi air sumur adalah ... orang.
Matematika
Level 7
Statistika
Penyajian dan Pengolahan Data
Penyajian dan Pengolahan Data
Read the text below and answer the question.

picture: freepik.com
My name is Kirana. I am an artist. I draw everyday. I work in my gallery at Jalan Laksa Adisucipto, Yogyakarta. I usually draw scenery and famous people.
What does Kirana do? She is ....
Bahasa Inggris
Level 7
Bahasa Inggris
Describing oneself
Self Introduction
Cek Contoh Kuis Online
Kejar Kuis
Cek Contoh Bank Soal
Kejar Soal
Keliling sebuah persegi panjang sama dengan keliling sebuah persegi. Lebar persegi panjang lebih pendek 8 cm daripada panjangnya. Jika sisi persegi dapat diketahui dari persamaan: 5(s + 16) = 180, di mana s adalah sisi persegi, maka pernyataan berikut yang benar adalah ...
-34 : (32)0 + 27 = ...
Perhatikan gambar di atas. Gambar itu disebut …
Perhatikan gambar berikut!
Besar sudut ABC adalah ....
Penulisan teks deskripsi yang sesuai dengan struktur dan kaidah bahasa yang benar adalah ...
Cermati kutipan surat berikut ini.
Berdasarkan isi surat di atas, sifat si pengirim dulu waktu di sekolah adalah ....
Hasil dari:
Perhatikan biografi berikut!
(Sumber gambar: akurat.co)
Salah satu penyanyi Indonesia yang pernah berduet dengan banyak penyanyi kenamaan Indonesia adalah Iwan Fals. Beliau pernah membawakan lagu berjudul Percayalah Kasih bersama Jockie Surjoprajogo dan Vina Panduwinata. Penyanyi dengan nama asli Virgiawan Lisanto ini merupakan salah satu legenda di Indonesia. Gaya musik yang dibawakannya adalah pop, rock, country, hingga folk pop. Lirik dari lagu-lagu Iwan Fals banyak menceritakan masa-masa kelam era 1970 hingga 1980-an di bidang politik. Salah satu lagunya bersama Swarmi yang berjudul Bongkar menerima penghargaan 150 lagu terbaik sepanjang masa versi Majalah Rolling Stone peringkat 1.
(Dikutip dari berbagai sumber)
Di bawah ini merupakan gaya musik yang dibawakan oleh Iwan Fals, kecuali ….
Diagram lingkaran di bawah ini menunjukkan sumber air minum yang dikonsumsi oleh penduduk di Jawa Tengah tahun 2020.
Jika jumlah seluruh penduduk tersebut adalah 34.000.000 orang, maka jumlah penduduk yang mengonsumsi air sumur adalah ... orang.
Read the text below and answer the question.
picture: freepik.com
My name is Kirana. I am an artist. I draw everyday. I work in my gallery at Jalan Laksa Adisucipto, Yogyakarta. I usually draw scenery and famous people.
What does Kirana do? She is ....