Bank Soal Kimia SMA Sifat Koligatif Larutan
Soal
Soal Populer Hari Ini
Perhatikan gambar kubus berikut!
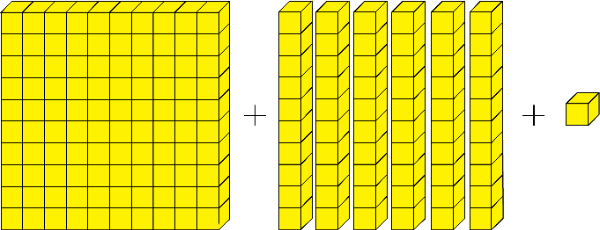
Dengan catatan:
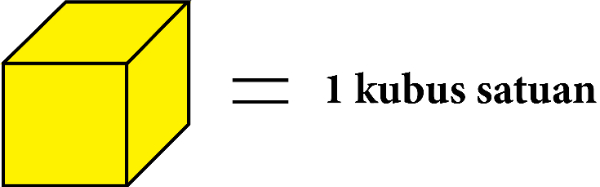
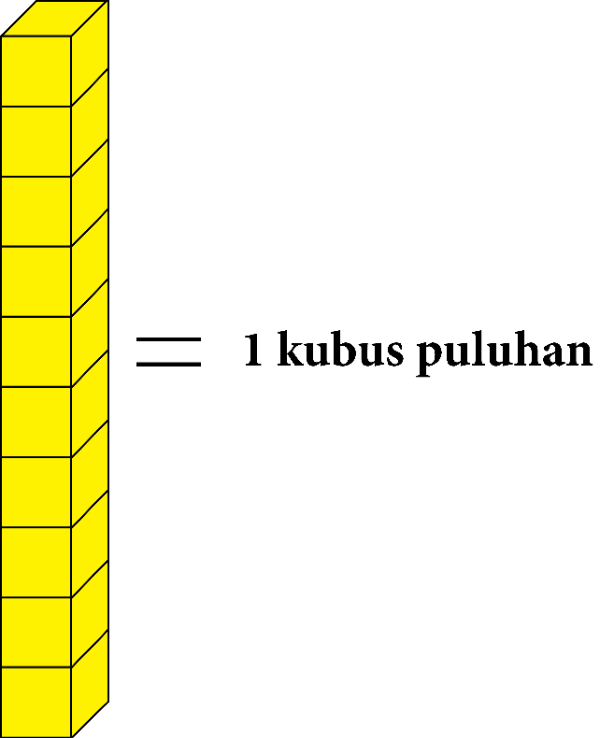
Kubus satuan yang berjumlah sepuluh digambarkan menjadi 1 kubus puluhan.
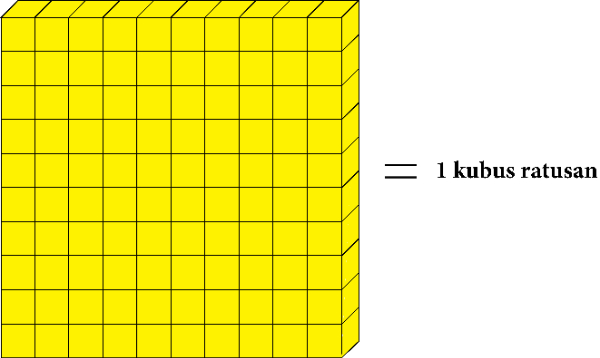
Dan kubus puluhan yang berjumlah sepuluh digambarkan menjadi kubus ratusan.
Banyaknya kubus pada gambar di atas ada ....
Matematika
Level 2
Bilangan
Mengenal Bilangan Cacah (0-999)
Mengenal Bilangan Sampai 999
Maaf, Tina. Aku tidak bisa ikut bermain bersama karena harus pergi bersama Ibu.
Ungkapan penolakan tersebut diucapkan seseorang untuk ....
Bahasa Indonesia
Level 2
Menulis
Ungkapan (1)
Ungkapan Penolakan
Perhatikan bangun ruang di bawah ini.

Berapa jumlah sisi yang dimiliki oleh bangun ruang tersebut?
Matematika
Level 2
Geometri
Bangun Ruang sederhana
Rusuk, Sisi, Ruas Garis
Perhatikan gambar uang berikut!

(Sumber Gambar: infoperbankan.com)
Pecahan nilai uang di atas dibaca ....
Matematika
Level 2
Bilangan
Nilai dan Kesetaraan Mata Uang
Nilai Mata Uang
Bu Ina ingin membeli kain batik.
Pilihan motif kain yang tersedia adalah sebagai berikut.

(Sumber Gambar: freepik.com)
Bu Ina memilih model kain batik dengan motif menyerupai bangun datar persegi panjang.
Motif kain batik yang dipilih Bu Ina adalah ....
Matematika
Level 2
Geometri
Bangun Datar Sederhana
Ciri-Ciri Bangun Datar Sederhana
Asa pergi ke toko.
Di toko tersebut menjual berbagai macam alat tulis.
Berikut adalah daftar harga berbagai macam alat tulis yang dijual.

(Sumber Gambar: flaticon.com)
Asa memiliki 1 lembar uang dua ribuan.
Ia ingin menggunakan uangnya untuk membeli 2 jenis barang tetapi masih mendapatkan uang kembalian.
Barang yang dapat dibeli Asa adalah ....
Matematika
Level 2
Bilangan
Nilai dan Kesetaraan Mata Uang
Kesetaraan Nilai Mata Uang
Arrange the jumbled letters.
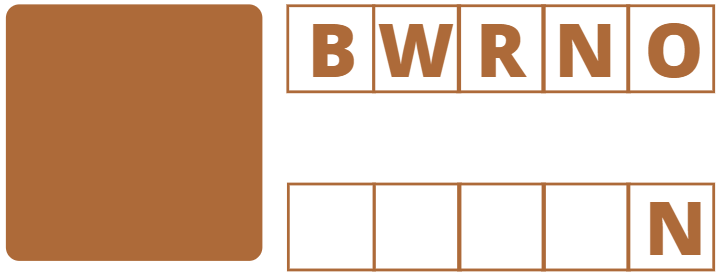
Source: canva
Bahasa Inggris
Level 2
A NEW FRIEND
Manakah yang disebut jam analog?
Matematika
Level 2
Bilangan
Satuan Waktu, Panjang, dan Berat
Mengenal Alat Ukur Waktu
Perhatikan puisi berikut.
Terjatuh
Aku terjatuh saat berlari
Lututku berdarah
Perih terasa
Aku sangat sedih
karena tidak bisa bermain
tidak bisa kejar-kejaran
Ekspresi yang sesuai dengan puisi tersebut adalah ….
Bahasa Indonesia
Level 2
Membaca
Puisi Anak
Lafal, Intonasi, dan Ekspresi dalam Membaca Puisi
Terdapat dua buah bilangan.
Kedua bilangan memiliki nilai ratusan yang sama.
Tetapi bilangan pertama memiliki nilai puluhan yang lebih besar dari bilangan kedua.
Sebaliknya, nilai satuan pada bilangan kedua lebih besar dari bilangan pertama.
Bilangan pertama dan kedua berturut-turut yang sesuai adalah ....
Matematika
Level 2
Bilangan
Mengenal Bilangan Cacah (0-999)
Menentukan Nilai Tempat Bilangan
Cek Contoh Kuis Online
Kejar Kuis
Cek Contoh Bank Soal
Kejar Soal
Perhatikan gambar kubus berikut!
Dengan catatan:
Kubus satuan yang berjumlah sepuluh digambarkan menjadi 1 kubus puluhan.
Dan kubus puluhan yang berjumlah sepuluh digambarkan menjadi kubus ratusan.

Banyaknya kubus pada gambar di atas ada ....
Maaf, Tina. Aku tidak bisa ikut bermain bersama karena harus pergi bersama Ibu.
Ungkapan penolakan tersebut diucapkan seseorang untuk ....
Perhatikan bangun ruang di bawah ini.
Berapa jumlah sisi yang dimiliki oleh bangun ruang tersebut?
Perhatikan gambar uang berikut!
(Sumber Gambar: infoperbankan.com)
Pecahan nilai uang di atas dibaca ....
Bu Ina ingin membeli kain batik.
Pilihan motif kain yang tersedia adalah sebagai berikut.
(Sumber Gambar: freepik.com)
Bu Ina memilih model kain batik dengan motif menyerupai bangun datar persegi panjang.
Motif kain batik yang dipilih Bu Ina adalah ....
Asa pergi ke toko.
Di toko tersebut menjual berbagai macam alat tulis.
Berikut adalah daftar harga berbagai macam alat tulis yang dijual.
(Sumber Gambar: flaticon.com)
Asa memiliki 1 lembar uang dua ribuan.
Ia ingin menggunakan uangnya untuk membeli 2 jenis barang tetapi masih mendapatkan uang kembalian.
Barang yang dapat dibeli Asa adalah ....
Arrange the jumbled letters.
Source: canva
Manakah yang disebut jam analog?
Perhatikan puisi berikut.
Terjatuh
Aku terjatuh saat berlari
Lututku berdarah
Perih terasa
Aku sangat sedih
karena tidak bisa bermain
tidak bisa kejar-kejaran
Ekspresi yang sesuai dengan puisi tersebut adalah ….
Terdapat dua buah bilangan.
Kedua bilangan memiliki nilai ratusan yang sama.
Tetapi bilangan pertama memiliki nilai puluhan yang lebih besar dari bilangan kedua.
Sebaliknya, nilai satuan pada bilangan kedua lebih besar dari bilangan pertama.
Bilangan pertama dan kedua berturut-turut yang sesuai adalah ....







