Bank Soal Kimia SMA Stoikiometri Persamaan Reaksi
Soal
Soal Populer Hari Ini
9.200 dibaca ....
Matematika
Level 3
Bilangan
Bilangan Cacah dan Pecahan Sederhana
Membilang Sampai 10.000
Kelas III
Kurikulum 2013
K13
Matematika
Berikut ini adalah hasil laut yang terjual di sebuah perkampungan nelayan selama satu minggu.
- Kerang 45 kg
- Ikan tuna 60 kg
- Ikan salmon 25 kg
- Udang 40 kg
- Cumi 30 kg
Manakah dari tabel di bawah ini yang sesuai dengan data tersebut?
Matematika
Level 3
Statistika
Data
Mengumpulkan dan Menyajikan Data
Kelas III
Kurikulum 2013
K13
Matematika
Perhatikan ilustrasi perubahan zat berikut!
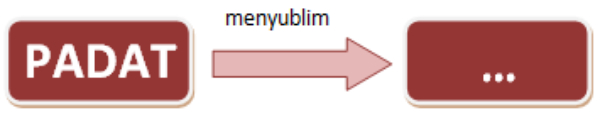
Kata yang tepat untuk mengisi kotak yang kosong adalah ....
Bahasa Indonesia
Level 3
Menulis
Informasi tentang Konsep
Menyajikan Hasil Informasi
Perhatikan denah berikut!
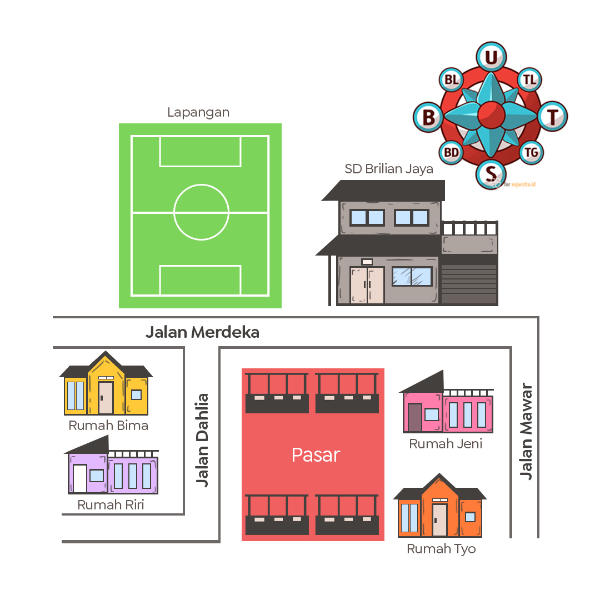
Lapangan sepak bola berada di sebelah ... rumah Jeni.
Bahasa Indonesia
Level 3
Menulis
Informasi Delapan Mata Angin
Membaca Denah
Mutia mengisi botol air dengan gelas hingga penuh.
Berikut adalah gambaran botol air yang diisi Mutia hingga penuh dengan gelas.
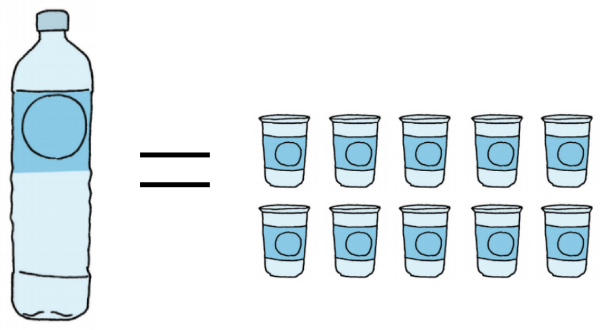
(Sumber Gambar: Buku BSE Kelas 3)
Arti dari gambaran di atas adalah ...
Matematika
Level 3
Geometri
Volume Bangun Ruang
Konsep Volume
Kelas III
Kurikulum 2013
K13
Matematika
Perhatikan gambar berikut!

(Sumber Gambar: freepik.com)
Bentuk pecahan yang sesuai dengan gambar di atas adalah ....
Matematika
Level 3
Bilangan
Pecahan Sederhana
Menentukan Nilai Pecahan
Kelas III
Kurikulum 2013
K13
Matematika
8 m = ... cm
Matematika
Level 3
Geometri
Pengukuran Waktu, Panjang, Berat
Hubungan Antarsatuan Panjang
Kelas III
Kurikulum 2013
K13
Matematika
Panjang persegi panjang 8 cm. Luas persegi panjang tersebut 40 cm2. Keliling persegi panjang ... cm.
Matematika
Level 3
Geometri
Bangun Datar
Keliling dan Luas Bangun Datar
Kelas III
Kurikulum 2013
K13
Matematika
Cermati dialog wawancara berikut!

Dika : Kak Fatir punya berapa kelinci?
Kak Fatir: Kakak punya dua kelinci, Dika.
Dika : Apa saja yang harus disiapkan kalau ingin memelihara kelinci, Kak?
Kak Fatir: Untuk memelihara kelinci, kita perlu menyiapkan makanan, kandang, dan kotak kotoran. Selain itu, sebaiknya kita memelihara lebih dari satu kelinci.
Dika : Kalau aku hanya memelihara satu kelinci, apa yang akan terjadi, Kak?
Kak Fatir: Kelinci adalah hewan sosial. Jadi, kalau kita hanya memelihara satu kelinci, ia tidak akan berumur panjang.
Dika: Apakah kelinci hanya makan wortel, Kak?
Kak Fatir: Kelinci tidak hanya makan wortel, tetapi juga rumput jerami, daun selada, pepaya, melon, dan pisang.
Dika : Apa saja yang harus diperhatikan saat menyiapkan kandang kelinci, Kak?
Kak Fatir: Kandang harus ditempatkan di dalam ruangan karena kelinci tidak tahan dengan cuaca panas. Ukuran kandang kelinci minimal lima kali ukuran tubuh kelinci.
Dika: Tadi Kakak juga mengatakan kalau kita harus menyiapkan kotak kotoran. Di mana Kakak meletakkan kotak kotoran?
Kak Fatir: Kakak meletakkannya di dekat tempat makanan kelinci.
Pewawancara dalam teks wawancara di atas adalah ....
Bahasa Indonesia
Level 3,15
Menulis
Wawancara
Menggali Informasi melalui Wawancara
inferensi, koneksi, dan prediksi teks
AKM
Asesmen Kompetensi Minimum
Saintifik
Teks Informasi
Literasi
Level 2
Bacalah dongeng berikut!

Musang yang Tidak Sabar
Alkisah, hiduplah binatang musang dan keluarganya. Keluarga musang sedang diburu oleh warga karena sering memakan ayam milik warga. Keluarga musang kini berdiam diri di rumah.
Musang Kecil merasa sangat lapar. Ia menolak ajakan ayahnya untuk mencari ikan. Musang Kecil tak sabar untuk memakan daging ayam. Tanpa seizin ayahnya, Musang pergi ke desa.
Sesampainya di desa, Musang Kecil menemukan ayam yang ia cari. Namun, sebelum Musang Kecil memakannya, ia masuk ke dalam jaring jebakan. Rupanya warga telah memasang perangkap untuk menangkap musang.
(Sumber: 1000dongeng.com, dengan penyesuaian)
Pesan yang sesuai dengan isi dongeng tersebut adalah ....
Bahasa Indonesia
Level 3
Menulis
Pesan dalam Dongeng
Menguraikan Pesan
Cek Contoh Kuis Online
Kejar Kuis
Cek Contoh Bank Soal
Kejar Soal
9.200 dibaca ....
Berikut ini adalah hasil laut yang terjual di sebuah perkampungan nelayan selama satu minggu.
- Kerang 45 kg
- Ikan tuna 60 kg
- Ikan salmon 25 kg
- Udang 40 kg
- Cumi 30 kg
Manakah dari tabel di bawah ini yang sesuai dengan data tersebut?
Perhatikan ilustrasi perubahan zat berikut!
Kata yang tepat untuk mengisi kotak yang kosong adalah ....
Perhatikan denah berikut!
Lapangan sepak bola berada di sebelah ... rumah Jeni.
Mutia mengisi botol air dengan gelas hingga penuh.
Berikut adalah gambaran botol air yang diisi Mutia hingga penuh dengan gelas.
(Sumber Gambar: Buku BSE Kelas 3)
Arti dari gambaran di atas adalah ...
Perhatikan gambar berikut!
(Sumber Gambar: freepik.com)
Bentuk pecahan yang sesuai dengan gambar di atas adalah ....
8 m = ... cm
Panjang persegi panjang 8 cm. Luas persegi panjang tersebut 40 cm2. Keliling persegi panjang ... cm.
Cermati dialog wawancara berikut!
Dika : Kak Fatir punya berapa kelinci?
Kak Fatir: Kakak punya dua kelinci, Dika.
Dika : Apa saja yang harus disiapkan kalau ingin memelihara kelinci, Kak?
Kak Fatir: Untuk memelihara kelinci, kita perlu menyiapkan makanan, kandang, dan kotak kotoran. Selain itu, sebaiknya kita memelihara lebih dari satu kelinci.
Dika : Kalau aku hanya memelihara satu kelinci, apa yang akan terjadi, Kak?
Kak Fatir: Kelinci adalah hewan sosial. Jadi, kalau kita hanya memelihara satu kelinci, ia tidak akan berumur panjang.
Dika: Apakah kelinci hanya makan wortel, Kak?
Kak Fatir: Kelinci tidak hanya makan wortel, tetapi juga rumput jerami, daun selada, pepaya, melon, dan pisang.
Dika : Apa saja yang harus diperhatikan saat menyiapkan kandang kelinci, Kak?
Kak Fatir: Kandang harus ditempatkan di dalam ruangan karena kelinci tidak tahan dengan cuaca panas. Ukuran kandang kelinci minimal lima kali ukuran tubuh kelinci.
Dika: Tadi Kakak juga mengatakan kalau kita harus menyiapkan kotak kotoran. Di mana Kakak meletakkan kotak kotoran?
Kak Fatir: Kakak meletakkannya di dekat tempat makanan kelinci.
Pewawancara dalam teks wawancara di atas adalah ....
Bacalah dongeng berikut!
Musang yang Tidak Sabar
Alkisah, hiduplah binatang musang dan keluarganya. Keluarga musang sedang diburu oleh warga karena sering memakan ayam milik warga. Keluarga musang kini berdiam diri di rumah.
Musang Kecil merasa sangat lapar. Ia menolak ajakan ayahnya untuk mencari ikan. Musang Kecil tak sabar untuk memakan daging ayam. Tanpa seizin ayahnya, Musang pergi ke desa.
Sesampainya di desa, Musang Kecil menemukan ayam yang ia cari. Namun, sebelum Musang Kecil memakannya, ia masuk ke dalam jaring jebakan. Rupanya warga telah memasang perangkap untuk menangkap musang.
(Sumber: 1000dongeng.com, dengan penyesuaian)
Pesan yang sesuai dengan isi dongeng tersebut adalah ....







