Bank Soal Kimia SMA Sel Elektrolisis dan Perhitungannya
Soal
Soal Populer Hari Ini
sama dengan ...
Pilih semua jawaban yang benar.
Matematika
Level 4
Bilangan
Pecahan
Bentuk Pecahan
Sebuah segitiga mempunyai tinggi 20 cm dan alas 8 cm. Luas segitiga tersebut adalah ... cm2
Matematika
Level 4
Geometri
Bangun Datar
Keliling dan Luas Segitiga
Di bawah ini adalah unsur-unsur yang terdapat di dalam sebuah karya sastra, kecuali ....
Bahasa Indonesia
Level 4
Membaca
Buku Sastra
Ulasan Buku Sastra

Source: freepik.com
Put the words in the correct order to make a good sentence.
chef / is / a / she
The correct order is ...
Bahasa Inggris
Level 4
Bahasa Inggris
Jobs
Simple Present Tense
Faktor persekutuan dari 32 dan 36 adalah …
Matematika
Level 4
Bilangan
Faktor dan Kelipatan
Faktor Persekutuan
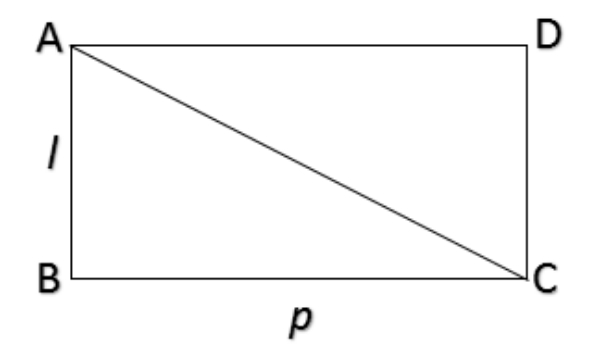
Perhatikan gambar di atas!
Rumus untuk mencari luas bangun ABC adalah ...
Matematika
Level 4
Geometri
Bangun Datar
Keliling dan Luas Persegi Panjang
2 x 32 x 52 adalah faktorisasi dari ....
Matematika
Level 4
Bilangan
FPB dan KPK
Faktor dan Faktorisasi Prima
Cermati teks berikut!
Kancil dan Siput Adu Lari

Pagi itu, kancil berpapasan dengan seekor siput di pinggir sungai. Melihat langkah siput yang sangat lambat, terbitlah rasa sombong sang kancil. "Hei siput, jalanmu lambat sekali! Coba lihat, aku bisa berlari ke ujung jalan di sana dan kembali lagi sebelum kamu selesai satu langkah!" Siput seperti tidak mendengar ujaran sang kancil dan terus berjalan dengan santai. Panas hati sang kancil karena tidak ditanggapi oleh si siput. "Siput bodoh, kamu pasti tidak akan bisa mengalahkanku dalam adu lari!" hina sang kancil.
Tak disangka-sangka, kali ini siput menjawab,"Ayo saja, kita buktikan siapa yang menang adu lari. Kalau aku menang, kamu harus mengaku kalah dan minta maaf kepadaku." Kancil tercengang mendengar keberanian sang siput, lalu menyetujui tantangan itu,"Baik, kalau begitu mari kita adu lari besok pagi di tempat ini juga."
Setelah kancil pergi, siput segera mengumpulkan saudara-saudaranya sesama siput. Ia menjelaskan rencananya untuk mengalahkan sang kancil. Sepanjang sisa hari itu semua siput akan bergerak menempatkan diri di sepanjang sungai, sehingga terdapat seekor siput setiap jarak tertentu. Lalu mereka menunggu di tempatnya masing-masing hingga pertandingan dimulai esok paginya. Beberapa siput sisanya ia tugaskan untuk menyebarkan berita lomba ini ke seluruh hutan.
Waktu pertandingan telah tiba. Banyak hewan hutan telah datang untuk menonton adu lari ini. Dengan tenangnya si siput berujar,"Hai kancil, hewan-hewan hutan akan menjadi saksi pemenang adu lari ini. Bersiap-siaplah untuk mengaku kalah!" Sang kancil jadi merasa gugup karena siput begitu percaya diri.
Begitu tanda mulai diberikan, kancil langsung melesat jauh di depan siput. Ketika kancil mulai merasa lelah, ia berhenti sebentar dengan niat mau beristirahat. Dengan ragu-ragu ia memanggil,"Put, siput?" "Ya, aku di sini," jawab salah satu siput yang berada di dekatnya. Merasa panik, kancil tidak jadi istirahat dan segera lanjut berlari seperti kesurupan. Setelah beberapa kali mendengar jawaban siput seperti itu, ia pun menyerah karena tidak kuat berlari lagi. Seluruh isi hutan pun terkejut dan bersorak sorai melihat kancil mengaku kalah dan meminta maaf pada siput.
Latar waktu dari cerita di atas adalah ....
Bahasa Indonesia
Level 4
Membaca
Teks Fiksi-Tokoh Cerita
Dongeng
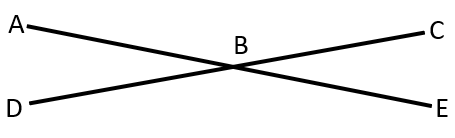
Jika besar sudut DBE 1500, maka besar sudut ABD adalah …
Matematika
Level 6
Geometri
Garis dan Sudut
Sudut
Berikut adalah diagram batang jumlah coklat yang dimakan oleh sebuah keluarga di sebuah pesta.
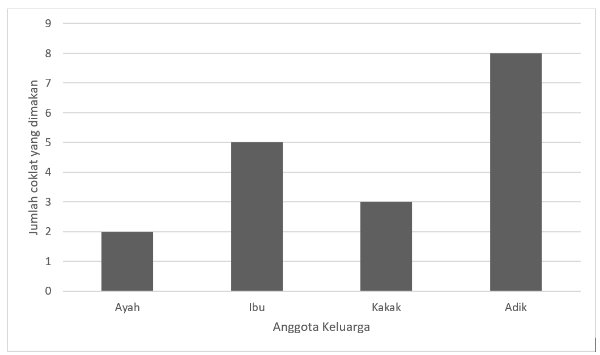
Jumlah coklat yang dimakan Ayah + Ibu ............. jumlah coklat yang dimakan Adik
Matematika
Level 4
Statistika
Bentuk Diagram
Membaca Diagram
Cek Contoh Kuis Online
Kejar Kuis
Cek Contoh Bank Soal
Kejar Soal
sama dengan ...
Pilih semua jawaban yang benar.
Sebuah segitiga mempunyai tinggi 20 cm dan alas 8 cm. Luas segitiga tersebut adalah ... cm2
Di bawah ini adalah unsur-unsur yang terdapat di dalam sebuah karya sastra, kecuali ....
Source: freepik.com
Put the words in the correct order to make a good sentence.
chef / is / a / she
The correct order is ...
Faktor persekutuan dari 32 dan 36 adalah …
Perhatikan gambar di atas!
Rumus untuk mencari luas bangun ABC adalah ...
2 x 32 x 52 adalah faktorisasi dari ....
Cermati teks berikut!
Kancil dan Siput Adu Lari
Pagi itu, kancil berpapasan dengan seekor siput di pinggir sungai. Melihat langkah siput yang sangat lambat, terbitlah rasa sombong sang kancil. "Hei siput, jalanmu lambat sekali! Coba lihat, aku bisa berlari ke ujung jalan di sana dan kembali lagi sebelum kamu selesai satu langkah!" Siput seperti tidak mendengar ujaran sang kancil dan terus berjalan dengan santai. Panas hati sang kancil karena tidak ditanggapi oleh si siput. "Siput bodoh, kamu pasti tidak akan bisa mengalahkanku dalam adu lari!" hina sang kancil.
Tak disangka-sangka, kali ini siput menjawab,"Ayo saja, kita buktikan siapa yang menang adu lari. Kalau aku menang, kamu harus mengaku kalah dan minta maaf kepadaku." Kancil tercengang mendengar keberanian sang siput, lalu menyetujui tantangan itu,"Baik, kalau begitu mari kita adu lari besok pagi di tempat ini juga."
Setelah kancil pergi, siput segera mengumpulkan saudara-saudaranya sesama siput. Ia menjelaskan rencananya untuk mengalahkan sang kancil. Sepanjang sisa hari itu semua siput akan bergerak menempatkan diri di sepanjang sungai, sehingga terdapat seekor siput setiap jarak tertentu. Lalu mereka menunggu di tempatnya masing-masing hingga pertandingan dimulai esok paginya. Beberapa siput sisanya ia tugaskan untuk menyebarkan berita lomba ini ke seluruh hutan.
Waktu pertandingan telah tiba. Banyak hewan hutan telah datang untuk menonton adu lari ini. Dengan tenangnya si siput berujar,"Hai kancil, hewan-hewan hutan akan menjadi saksi pemenang adu lari ini. Bersiap-siaplah untuk mengaku kalah!" Sang kancil jadi merasa gugup karena siput begitu percaya diri.
Begitu tanda mulai diberikan, kancil langsung melesat jauh di depan siput. Ketika kancil mulai merasa lelah, ia berhenti sebentar dengan niat mau beristirahat. Dengan ragu-ragu ia memanggil,"Put, siput?" "Ya, aku di sini," jawab salah satu siput yang berada di dekatnya. Merasa panik, kancil tidak jadi istirahat dan segera lanjut berlari seperti kesurupan. Setelah beberapa kali mendengar jawaban siput seperti itu, ia pun menyerah karena tidak kuat berlari lagi. Seluruh isi hutan pun terkejut dan bersorak sorai melihat kancil mengaku kalah dan meminta maaf pada siput.
Latar waktu dari cerita di atas adalah ....
Jika besar sudut DBE 1500, maka besar sudut ABD adalah …
Berikut adalah diagram batang jumlah coklat yang dimakan oleh sebuah keluarga di sebuah pesta.
Jumlah coklat yang dimakan Ayah + Ibu ............. jumlah coklat yang dimakan Adik







