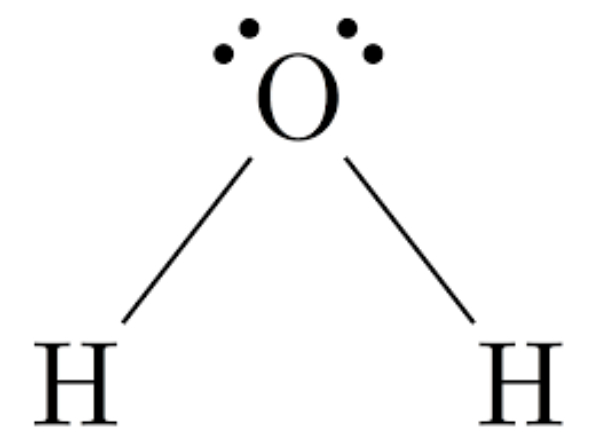
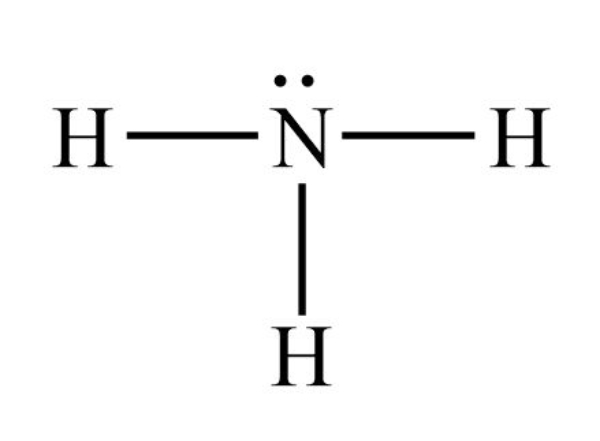
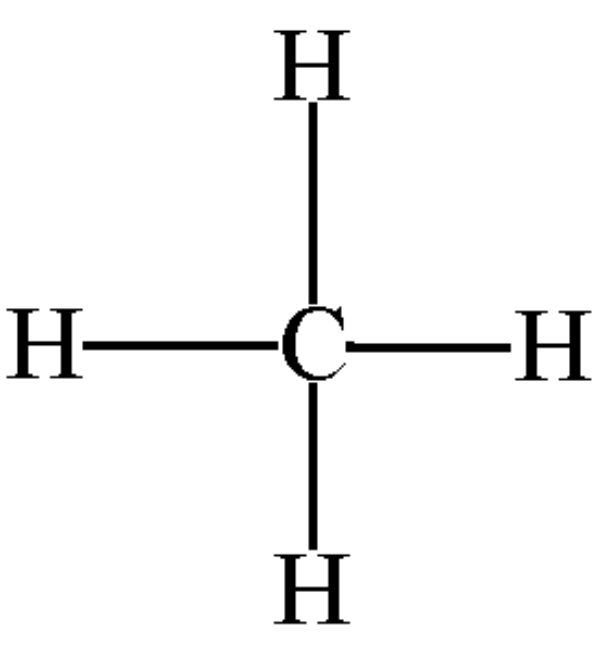
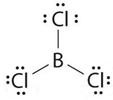
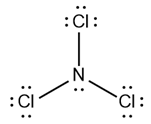
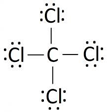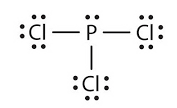Bank Soal Kimia SMA Ikatan Hidrogen dan Gaya van der Waals
Soal
Soal Populer Hari Ini
Matematika
Level 5
Bilangan
Operasi Hitung Pecahan
Operasi Hitung Pecahan Biasa dan Campuran

Andi mengikuti lomba menulis cerpen dalam iklan tersebut. Jika Andi berhasil menjadi juara II, hadiah yang berhasil didapatkan Andi adalah sertifikat dan uang sebesar ....
Bahasa Indonesia
Level 5
Membaca
Iklan
Identifikasi Informasi
Ayah dan Ibu akan pergi ke luar kota untuk menghadiri acara syukuran. Mereka berangkat pada pukul 13.00 dan harus sampai di lokasi pada pukul 15.00. Jika jarak kedua kota 144 km, maka kecepatan yang harus digunakan agar sampai tepat waktu yaitu…
Matematika
Level 5
Geometri
Perbandingan Dua Besaran
Kecepatan
Read the text below. Then, fill in the blank with a correct verb to be.

Source: creazilla.com
My name is Claire. I live in Arizona. I am in fifth grade. I have a brother. His name is Peter. He is in fourth grade.
Based on the text, we know that Claire and Peter ... students.
Bahasa Inggris
Level 5
Bahasa Inggris
Friendship
Self-Introduction
Ciri yang menunjukkan Indonesia sebagai negara maritim adalah ....
IPS
Level 5
Geografi
Karakteristik Geografi Wilayah Indonesia
Karakteristik Geografis
Perhatikan Jaring-jaring kubus berikut!

Jika sisi II menjadi alas maka yang menjadi sisi atas yaitu ..
Matematika
Level 5
Geometri
Balok dan Kubus
Sifat dan Jaring-Jaring Balok dan Kubus
Wayan dan Mirna berjualan kopi selama 4 hari yaitu Senin, Selasa, Rabu, Kamis. Jika minimal penjualan dalam sehari adalah 150 dan hasil penjualan tidak pernah lebih dari hari sebelumnya, maka manakah tabel dibawah yang tepat?
Matematika
Level 5
Statistika
Pengumpulan dan Penyajian Data
Menyajikan Data
Perhatikan diagram berikut!

Pernyataan yang sesuai dengan diagram di atas adalah ...
Matematika
Level 5
Statistika
Pengumpulan dan Penyajian Data
Membaca Data
Bacalah teks berikut!
Adat istiadat merupakan suatu sistem norma atau tata kelakuan yang tumbuh, berkembang, dan dijunjung tinggi oleh masyarakat secara turun-temurun. Adat istiadat juga merupakan kebiasaan sosial yang sejak lama telah ada di masyarakat dan bertujuan untuk mengatur tata tertib dalam masyarakat tersebut.
Keberagaman budaya menjadikan adat istiadat beragam pula. Adat istiadat terbentuk sesuai dengan kebiasaan masyarakat setempat. Setiap suku yang ada di Indonesia memiliki adat istiadat yang berbeda. Sebagai contoh, tradisi masyarakat Jawa berbeda dengan masyarakat NTT, Bali, maupun Papua. Adat istiadat memiliki aturan khusus yang mengikat masyarakat. Adat istiadat memiliki nilai budaya yang luhur, bersifat mengikat suatu kelompok masyarakat yang tinggal di daerah tertentu, dan memiliki sistem hukum yang tegas bagi seluruh masyarakat.
Meskipun setiap daerah memiliki adat istiadatnya masing-masing, namun Indonesia harus tetap hidup rukun dan damai. Saling menghormati antar suku dan budaya seperti semboyan Bangsa Indonesia yaitu Bhinneka Tunggal Ika, yang artinya berbeda-beda tetapi tetap satu. Perbedaan juga menjadi sebuah kekuatan sehingga memperkaya sifat budaya bangsa Indonesia serta persatuan dan kesatuan bangsa.
Teks tersebut termasuk jenis eksplanasi ....
Bahasa Indonesia
Level 5
Membaca
Teks Eksplanasi
Informasi Penting dalam Teks
Bacalah kutipan surat undangan berikut ini!
Dengan hormat,
Melalui surat ini, kami bermaksud mengundang Bapak/Ibu untuk hadir dalam acara pengambilan rapor semester ganjil untuk kelas I-VI tahun pelajaran 2019/2020. Acara tersebut akan dilaksanakan pada:
hari : Sabtu
tanggal : 7 Desember 2019
waktu : 09.00 WIB
tempat : Kelas masing-masing
Kami harap Bapak/Ibu dapat hadir tepat waktu. [...]
Kalimat efektif yang tepat untuk melengkapi kutipan surat undangan tersebut adalah ....
Bahasa Indonesia
Level 5
Membaca
Surat Undangan
Menulis Surat Undangan
Cek Contoh Kuis Online
Kejar Kuis
Cek Contoh Bank Soal
Kejar Soal
Andi mengikuti lomba menulis cerpen dalam iklan tersebut. Jika Andi berhasil menjadi juara II, hadiah yang berhasil didapatkan Andi adalah sertifikat dan uang sebesar ....
Ayah dan Ibu akan pergi ke luar kota untuk menghadiri acara syukuran. Mereka berangkat pada pukul 13.00 dan harus sampai di lokasi pada pukul 15.00. Jika jarak kedua kota 144 km, maka kecepatan yang harus digunakan agar sampai tepat waktu yaitu…
Read the text below. Then, fill in the blank with a correct verb to be.

Source: creazilla.com
My name is Claire. I live in Arizona. I am in fifth grade. I have a brother. His name is Peter. He is in fourth grade.
Based on the text, we know that Claire and Peter ... students.
Ciri yang menunjukkan Indonesia sebagai negara maritim adalah ....
Perhatikan Jaring-jaring kubus berikut!
Jika sisi II menjadi alas maka yang menjadi sisi atas yaitu ..
Wayan dan Mirna berjualan kopi selama 4 hari yaitu Senin, Selasa, Rabu, Kamis. Jika minimal penjualan dalam sehari adalah 150 dan hasil penjualan tidak pernah lebih dari hari sebelumnya, maka manakah tabel dibawah yang tepat?
Perhatikan diagram berikut!
Pernyataan yang sesuai dengan diagram di atas adalah ...
Bacalah teks berikut!
Adat istiadat merupakan suatu sistem norma atau tata kelakuan yang tumbuh, berkembang, dan dijunjung tinggi oleh masyarakat secara turun-temurun. Adat istiadat juga merupakan kebiasaan sosial yang sejak lama telah ada di masyarakat dan bertujuan untuk mengatur tata tertib dalam masyarakat tersebut.
Keberagaman budaya menjadikan adat istiadat beragam pula. Adat istiadat terbentuk sesuai dengan kebiasaan masyarakat setempat. Setiap suku yang ada di Indonesia memiliki adat istiadat yang berbeda. Sebagai contoh, tradisi masyarakat Jawa berbeda dengan masyarakat NTT, Bali, maupun Papua. Adat istiadat memiliki aturan khusus yang mengikat masyarakat. Adat istiadat memiliki nilai budaya yang luhur, bersifat mengikat suatu kelompok masyarakat yang tinggal di daerah tertentu, dan memiliki sistem hukum yang tegas bagi seluruh masyarakat.
Meskipun setiap daerah memiliki adat istiadatnya masing-masing, namun Indonesia harus tetap hidup rukun dan damai. Saling menghormati antar suku dan budaya seperti semboyan Bangsa Indonesia yaitu Bhinneka Tunggal Ika, yang artinya berbeda-beda tetapi tetap satu. Perbedaan juga menjadi sebuah kekuatan sehingga memperkaya sifat budaya bangsa Indonesia serta persatuan dan kesatuan bangsa.
Teks tersebut termasuk jenis eksplanasi ....
Bacalah kutipan surat undangan berikut ini!
Dengan hormat,
Melalui surat ini, kami bermaksud mengundang Bapak/Ibu untuk hadir dalam acara pengambilan rapor semester ganjil untuk kelas I-VI tahun pelajaran 2019/2020. Acara tersebut akan dilaksanakan pada:
hari : Sabtu tanggal : 7 Desember 2019 waktu : 09.00 WIB tempat : Kelas masing-masing
Kami harap Bapak/Ibu dapat hadir tepat waktu. [...]
Kalimat efektif yang tepat untuk melengkapi kutipan surat undangan tersebut adalah ....