Bank Soal Kimia SMA Sifat Koligatif Larutan Elektrolit
Soal
Soal Populer Hari Ini
Nilai tempat ratusan pada bilangan 3.714 adalah ....
Matematika
Level 3
Bilangan
Bilangan Cacah dan Pecahan Sederhana
Membilang Sampai 10.000
Perhatikan gambar di bawah ini!

(Sumber: www.startfmmadina.com)
Kegunaan benda gas di atas adalah ....
Bahasa Indonesia
Level 3
Menulis
Informasi tentang Konsep
Menggali Informasi Konsep Perubahan Wujud Benda
Berikut adalah tabel data hewan peliharaan yang dimiliki siswa kelas III.
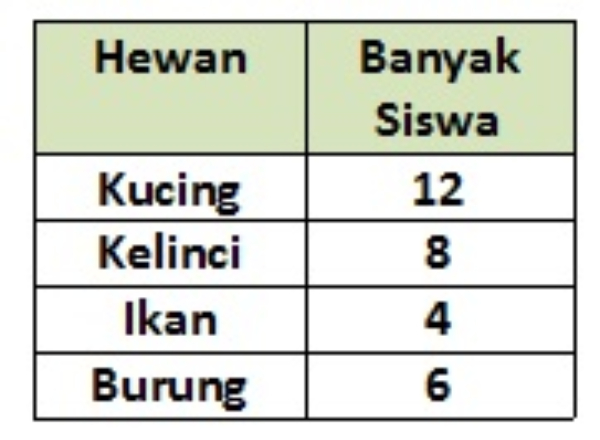
Diagram gambar yang sesuai dengan data tersebut adalah ....
Matematika
Level 3
Statistika
Data
Mengumpulkan dan Menyajikan Data
Perhatikan denah berikut!
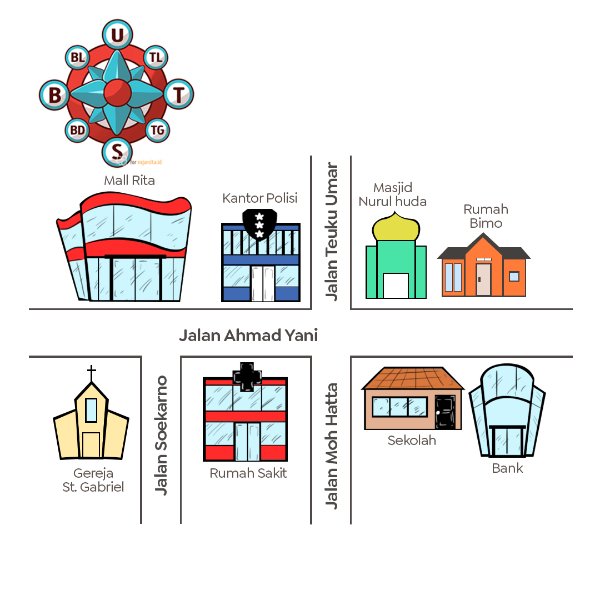
Jika Bimo ingin ke mall Rita dari rumahnya, maka ia bisa melewati ....
Bahasa Indonesia
Level 3
Menulis
Informasi Delapan Mata Angin
Membaca Denah
Perhatikan gambar berikut!
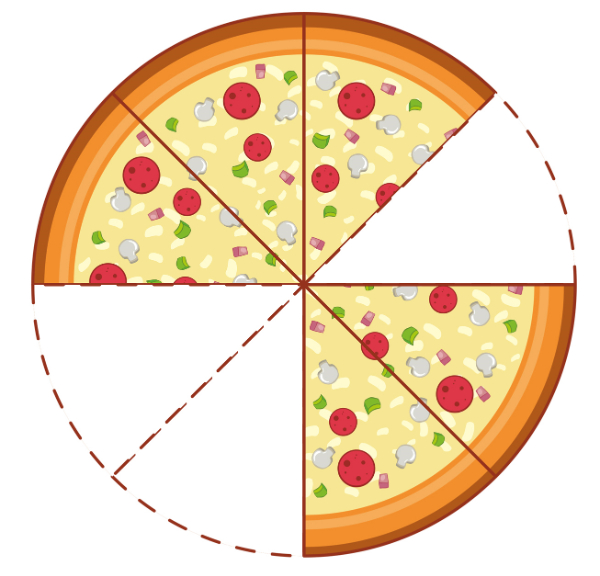
(Sumber Gambar: freepik.com)
Bentuk pecahan sisa potongan pizza yang sesuai dengan gambar di atas adalah ....
Matematika
Level 3
Bilangan
Pecahan Sederhana
Menentukan Nilai Pecahan
8 m = ... cm
Matematika
Level 3
Geometri
Pengukuran Waktu, Panjang, Berat
Hubungan Antarsatuan Panjang
Ovie membuat jus jeruk dengan blender.
Jus jeruk yang ada di dalam blender akan dibagikan ke beberapa gelas.
Volume jus jeruk dalam blender setara dengan 4 satuan gelas.
Gambaran yang sesuai adalah ....
Matematika
Level 3
Geometri
Volume Bangun Ruang
Konsep Volume
Berikut yang bukan merupakan jenis sudut adalah ....
Matematika
Level 3
Geometri
Bangun Datar
Jenis dan Besar Sudut
2.300 + 1.100 = ....
Matematika
Level 3
Bilangan
Operasi Hitung Bilangan Cacah
Operasi Hitung Bilangan Cacah
Percakapan antara dua orang atau lebih yang berlangsung antara narasumber dan pewawancara disebut ....
Bahasa Indonesia
Level 3
Menulis
Wawancara
Menggali Informasi melalui Wawancara
Cek Contoh Kuis Online
Kejar Kuis
Cek Contoh Bank Soal
Kejar Soal
Nilai tempat ratusan pada bilangan 3.714 adalah ....
Perhatikan gambar di bawah ini!

(Sumber: www.startfmmadina.com)
Kegunaan benda gas di atas adalah ....
Berikut adalah tabel data hewan peliharaan yang dimiliki siswa kelas III.
Diagram gambar yang sesuai dengan data tersebut adalah ....
Perhatikan denah berikut!
Jika Bimo ingin ke mall Rita dari rumahnya, maka ia bisa melewati ....
Perhatikan gambar berikut!
(Sumber Gambar: freepik.com)
Bentuk pecahan sisa potongan pizza yang sesuai dengan gambar di atas adalah ....
8 m = ... cm
Ovie membuat jus jeruk dengan blender.
Jus jeruk yang ada di dalam blender akan dibagikan ke beberapa gelas.
Volume jus jeruk dalam blender setara dengan 4 satuan gelas.
Gambaran yang sesuai adalah ....
Berikut yang bukan merupakan jenis sudut adalah ....
2.300 + 1.100 = ....
Percakapan antara dua orang atau lebih yang berlangsung antara narasumber dan pewawancara disebut ....







