Bank Soal Kimia SMA Penurunan Tekanan Uap
Soal
LOTS
Soal Populer Hari Ini
32 ... 23
Matematika
Level 7
Bilangan
Bilangan dan Operasi Hitung Bilangan
Bilangan Berpangkat
Kelas VII
Kurikulum 2013
K13
Matematika
Diketahui persamaan 5(3x + 8) = 2 (3x + 2), maka nilai x adalah ....
Matematika
Level 7
Aljabar
Persamaan dan Pertidaksamaan Linear Satu Variabel
Persamaan Linear Satu Variabel (PLSV)
Kelas VII
Kurikulum 2013
K13
Matematika
Perhatikan gambar berikut.

Bagian yang diarsir menunjukkan …
Matematika
Level 7
Bilangan
Himpunan
Konsep dan Macam-Macam Himpunan
Diketahui dua garis sejajar yang dipotong oleh sebuah garis lain. Pasangan sudut yang memiliki jumlah 180o adalah ....
Matematika
Level 7
Geometri
Garis dan Sudut
Hubungan Antar Sudut
Kelas VII
Kurikulum 2013
K13
Matematika
Berikut ini adalah bagian-bagian surat yang hanya terdapat dalam surat dinas, yaitu ....
Bahasa Indonesia
Level 7
Menulis
Surat Pribadi dan Surat Dinas
Unsur-unsur dan Kebahasaan Surat
Kelas VII
Kurikulum 2013
K13
Bahasa Indonesia
Ketika Anda berkunjung ke Yogyakarta, sebaiknya menyempatkan diri untuk mengunjungi salah satu gua peninggalan Jepang yang berada di Kaliurang. Gua ini dulunya berfungsi sebagai tempat tinggal dan berlindung oleh tentara Jepang dari serangan sekutu. Letak gua yang berada di pegunungan membuat udara terasa sejuk. Selain itu gua ini juga masih sangat orisinal dan tanpa penerangan. Namun dengan biaya yang sangat terjangkau, pengunjung dapat menyewa fasilitas penerangan, bahkan ditemani oleh seorang pemandu. Pemandu akan menemani dan menjelaskan berbagai hal tentang gua ini, sehingga pengunjung tidak perlu merasa khawatir. Tidak hanya itu, pengunjung juga dapat menyaksikan keindahan Gunung Merapi dari dekat. Pengunjung akan mendapatkan dua manfaat sekaligus, yaitu menikmati keindahan alam sembari memperoleh pengetahuan mengenai sejarah penjajahan Jepang di Indonesia.
Teks di atas membicarakan tentang ....
Bahasa Indonesia
Level 7
Menulis
Teks Deskripsi
Menentukan Isi Teks Deskripsi
KD4.1
Kelas VII
Kurikulum 2013
K13
Bahasa Indonesia
Hasil dari
Matematika
Level 7
Aljabar
Bentuk Aljabar
Operasi Hitung Bentuk Aljabar
Kelas VII
Kurikulum 2013
K13
Matematika
Ide pengembangan buku nonfiksi berdasarkan ....
Bahasa Indonesia
Level 7
Menulis
Buku Fiksi dan Nonfiksi
Unsur Pembangun Buku Fiksi dan Nonfiksi
KD3.9
Kelas VII
Kurikulum 2013
K13
Bahasa Indonesia
Tabel di bawah ini memperlihatkan data kegiatan ekstrakurikuler di SMP Merdeka pada tahun 2020.
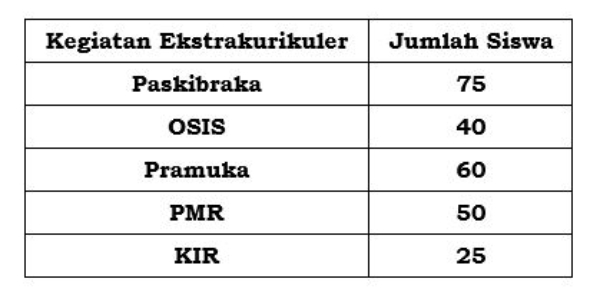
Diagram lingkaran dari tabel tersebut adalah ....
Matematika
Level 7
Statistika
Penyajian dan Pengolahan Data
Penyajian dan Pengolahan Data
Video
Kelas VII
Kurikulum 2013
K13
Matematika
Read the text below and fill the blanks with correct answers according to the relationship to the writer.
This is my family. Every holiday, my aunt and uncle bring their son Andre to visit me. He is my ... (1). My brother and his wife also come to visit my parents. They have a son, named Angga, my cute ... (2). My mother and father would really love to meet their ..., Angga (3).
The best word to fill number (2) is ....
Bahasa Inggris
Level 7
Bahasa Inggris
Describing oneself
Vocabulary: Family Tree
Kelas VII
Kurikulum 2013
K13
Cek Contoh Kuis Online
Kejar Kuis
Cek Contoh Bank Soal
Kejar Soal
32 ... 23
Diketahui persamaan 5(3x + 8) = 2 (3x + 2), maka nilai x adalah ....
Perhatikan gambar berikut.
Bagian yang diarsir menunjukkan …
Diketahui dua garis sejajar yang dipotong oleh sebuah garis lain. Pasangan sudut yang memiliki jumlah 180o adalah ....
Berikut ini adalah bagian-bagian surat yang hanya terdapat dalam surat dinas, yaitu ....
Ketika Anda berkunjung ke Yogyakarta, sebaiknya menyempatkan diri untuk mengunjungi salah satu gua peninggalan Jepang yang berada di Kaliurang. Gua ini dulunya berfungsi sebagai tempat tinggal dan berlindung oleh tentara Jepang dari serangan sekutu. Letak gua yang berada di pegunungan membuat udara terasa sejuk. Selain itu gua ini juga masih sangat orisinal dan tanpa penerangan. Namun dengan biaya yang sangat terjangkau, pengunjung dapat menyewa fasilitas penerangan, bahkan ditemani oleh seorang pemandu. Pemandu akan menemani dan menjelaskan berbagai hal tentang gua ini, sehingga pengunjung tidak perlu merasa khawatir. Tidak hanya itu, pengunjung juga dapat menyaksikan keindahan Gunung Merapi dari dekat. Pengunjung akan mendapatkan dua manfaat sekaligus, yaitu menikmati keindahan alam sembari memperoleh pengetahuan mengenai sejarah penjajahan Jepang di Indonesia.
Teks di atas membicarakan tentang ....
Hasil dari
Ide pengembangan buku nonfiksi berdasarkan ....
Tabel di bawah ini memperlihatkan data kegiatan ekstrakurikuler di SMP Merdeka pada tahun 2020.
Diagram lingkaran dari tabel tersebut adalah ....
Read the text below and fill the blanks with correct answers according to the relationship to the writer.
This is my family. Every holiday, my aunt and uncle bring their son Andre to visit me. He is my ... (1). My brother and his wife also come to visit my parents. They have a son, named Angga, my cute ... (2). My mother and father would really love to meet their ..., Angga (3).
The best word to fill number (2) is ....







