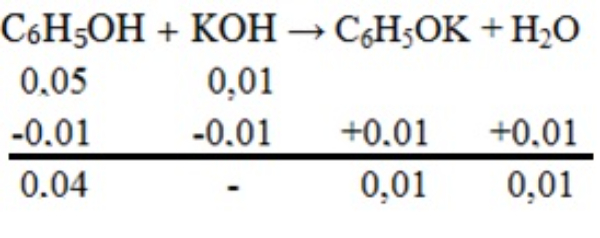
Bank Soal Kimia SMA Nilai pH dan Prinsip Kerja Larutan Penyangga
Soal
LOTS
Soal Populer Hari Ini
Read the text carefully.

PANCAKES
Serve with a little caster sugar or lemon juice.
This recipe is for 2 adults and 2 kids.
Preparation time: 10 minutes
Cooking time: 15 minutes
Ingredients:
- 225 g of plain flour
- 1 egg
- 425 ml of low-fat milk
- Pinch of salt if desired
Methods:
- Sieve the flour and salt into a bowl
- Make a hoe in the center of the flour and drop in the egg with ¼ of the milk.
- Stir the egg mixture in the center of the bowl with a wooden spoon, allowing the flour to fall in gradually from the sides.
- Add the rest of the milk slowly, beating well avoid lumps.
- Pour a thin layer of the mixture onto a hot, non-stick pan.
- Use a spatula to turn the pancake over when bubbles start to appear on top.
Savory Fillings
- Chopped cooked chicken
- Smoked haddock
- Tinned salmon
- Mushrooms
- Mince cooked in curry sauce
- Bolognese sauce
Sweet Fillings
- Jam
- Stewed fruit
- Fried bananas
Source: 101 Square Meals by Safe Food
The recipe can be served for ... people.
Bahasa Inggris
Level 9
Bahasa Inggris
How to do or make things
Procedure Text
Observe the classroom reward chart below and answer the question.

Source: canva.com
Which of the following information is NOT stated on the chart?
Bahasa Inggris
Level 9
Bahasa Inggris
Using passive voice to describe things
Passive Voice
Cermati Teks Berikut!
Zat-zat makanan disebut juga gizi atau nutrisi. Makanan bergizi adalah makanan yang mengandung karbohidrat, protein, lemak (lipid), vitamin, dan mineral dalam jumlah yang mencukupi kebutuhan tubuh. Karbohidrat, protein, lemak diperlukan oleh tubuh dalam jumlah banyak sehingga disebut makronutrien. Sementara itu, vitamin dan mineral diperlukan oleh tubuh dalam jumlah yang sedikit sehingga disebut mikronutrien.
Karbohidrat berasal paling banyak pada tumbuh-tumbuhan yang melakukan fotosintesis. Karbohidrat dalam makanan berupa pati, sukrosa, laktosa, dan fruktosa. Lemak tersusun dari atom karbon, hidrogen, dan oksigen. Lemak terdiri atas gliserol dengan asam-asam lemak. Daging dan berbagai produk olahan susu mengandung asam lemak jenuh, sedangkan biji tanaman mengandung asam lemak tak jenuh. Protein tersusun dari atom karbon, hidrogen, oksigen, dan nitrogen. Pada beberapa jenis protein terdapat unsur-unsur mineral sulfur, fosfor, iodin, besi, dan kobalt. Sumber protein berasal dari daging berwarna merah, ikan, telur, susu, kerang, keju, dan kacang-kacangan.
(Sumber: academia.edu-Laporan Uji Zat Makanan, dengan penyesuaian)
Berdasarkan isinya, kutipan tersebut termasuk unsur teks laporan percobaan pada bagian ....
Bahasa Indonesia
Level 9
Menulis
Laporan Percobaan
Identifikasi Laporan Percobaan
Hasil dari adalah...
Matematika
Level 9
Bilangan
Bilangan Berpangkat dan Bentuk Akar
Bilangan Berpangkat
Sekolah Berdasarkan Sistem Zonasi, Setuju atau Tidak?
Ketua DPP PKS, Ledia Hanifah Amaliah, memberikan solusi kepada pemerintah terkait penentangan sistem zonasi. Hanifah mengatakan, "Solusi pertama, evaluasi menyeluruh kebijakan sistem zonasi. Kedua, beri keleluasaan pada daerah untuk menyesuaikan kondisinya."
Berdasarkan kutipan teks diskusi di atas, bagian isu yang tepat untuk melengkapinya adalah ...
Bahasa Indonesia
Level 9
Menulis
Teks Diskusi
Menulis Teks Diskusi
Langkah-Langkah Percobaan Membuat Tinta Tidak Terlihat
(1) Peras jus lemon ke dalam mangkuk dan tambahkan beberapa tetes air ke dalam mangkuk tersebut.
(2) Tunggu jus tersebut kering sehingga tidak terlihat.
(3) Untuk membaca pesan tersebut dapat dilakukan dengan memanaskan kertas yang dipegang dengan mendekatkannya ke bola lampu.
(4) Kemudian aduk air dan jus lemon dengan menggunakan sendok.
(5) Celupkan cotton bud ke dalam campuran dan tulis pesan di atas kertas putih.
Urutan langkah-langkah percobaan tersebut yang benar adalah ...
Bahasa Indonesia
Level 9
Menulis
Laporan Percobaan
Menulis Laporan Percobaan
Read the message for Diffa sent by Lina below and answer the question.

Template: canva.com
Which of the following expressions is not an expression of wishes and prayers?
Bahasa Inggris
Level 9
Bahasa Inggris
Appreciation over achievements or happiness
Expressions of Congratulations
Baca teks berikut ini dengan cermat.
Pemerintah Daerah Istimewa Yogyakarta berencana menerapkan konsep Malioboro bebas kendaraan bermotor. Konsep tata wilayah tersebut dimaksudkan untuk membuat kawasan Malioboro menjadi rapi dan tertib sehingga para pengunjung dan pedagang merasa lebih nyaman. Namun yang terjadi justru sebagian pedagang bukannya mendukung program tersebut, ... menolaknya. Mereka khawatir dagangannya menjadi sepi pembeli.
Konjungsi yang tepat untuk mengisi bagian yang rumpang pada teks di atas yaitu ....
Bahasa Indonesia
Level 9
Menulis
Teks Diskusi
Menulis Teks Diskusi
Baca teks berikut ini dengan cermat.
Seorang remaja asal Thailand yang tinggal di timur laut Provinsi Kalasin sedang menjadi buah bibir. Remaja tersebut menjadi buah bibir lantaran menjual lukisannya, mayoritas bergambar pemadangan desa, untuk memenuhi tanggungan biaya kuliahnya.
Remaja bernama Krittamet Saisaen, atau yang akrab disapa Earth tersebut bercita-cita menjadi seorang arsitek. Remaja berusia 18 tahun tersebut mengenang kesukaanya melukis pertama kali, yaitu ketika menemani ibunya saat dirawat di rumah sakit. Hobi menggambarnya memang sudah dimulai sejak ia masih kecil. Oleh karena itu, ia sangat berkeinginan menjadi seorang arsitek yang ahli mendesain bangunan.
Earth ingin mendaftar kuliah di Arsom Silp Institute of The Arts, Bangkok. Namun, biaya yang harus ia bayar untuk bisa menempuh kuliah di sana sebesar 60 ribu baht atau lebih dari 27 juta untuk satu semesternya. Untuk meraih gelar sarjana, ia harus menyelesaikan 10 semester atau memerlukan biaya sekitar 270 juta. Biaya kuliah yang sangat tinggi tersebut tak mampu ia penuhi. Apalagi orangtua Earth sudah tidak ada. Ibunya telah meninggal dunia dan ayahnya meninggalkannya beserta adiknya.
Earth tak patah semangat. Ia berharap bisa mendapatkan uang dengan menjual lukisannya. Ia menjual lukisannya kepada tetangga dengan harga 20 sampai 50 baht, atau sekitar 10 ribu sampai 23 ribu rupiah. Meskipun dibayar sedikit, ia tak patah semangat. Ia terus memoles keterampilannya lewat guru seninya dan video tutorial di Youtube.
Kehidupan Earth membaik setelah kisahnya tersebar di berbagai media sosial. Akibat hal tersebut, ia kemudian kebanjiran pesanan membuat lukisan. Pesanan lukisan tersebut dibayar dengan harga 1000 sampai 2000 bath.
Kerja keras Earth mengasah keterampilan dan gigih menjual lukisan akhirnya menuai hasil. Earth menjadi bukti sebagai anak muda yang berjuang meraih cita-citanya meskipun banyak halangan. Dari penghasilan yang ia dapatkan tersebut ia juga bercita-cita membangun pondok ramah lingkungan untuk mengajari anak-anak melukis.
(Sumber: Liputan6.com, dengan penyesuaian)
Gagasan pokok paragraf ketiga cerita inspiratif di atas adalah ...
Bahasa Indonesia
Level 9
Menulis
Cerita Inspiratif
Menulis Cerita Inspiratif
Baca teks berikut ini dengan cermat.
Bukan Uang, Sekolah Ini Minta Siswanya Bayar Pakai Sampah Plastik
Selama ini, plastik selalu dipandang sebagai masalah dan limbah yang mengotori lingkungan. Sebenarnya sampah juga mempunyai nilai guna apabila dilakukan daur ulang. Bahkan bagi sebagian orang sampah adalah barang yang berharga dan menjadi tumpuan hidup. Sebagaimana sebuah sekolah di India yang menggunakan sampah plastik sebagai pengganti uang sekolah yang harus dibayar oleh siswa.
Akshar Foundation adalah sekolah yang menerapkan program penerimaan limbah plastik untuk didaur ulang. Sekolah yang berada di Desa Pamohi, Guwahati, India tersebut didirikan oleh Parmita Sharma dan Mazin Mukthar. Program daur ulang limbah yang sekolah mereka terapkan juga mengajak siswa terlibat dalam pengumpulan dan pemisahan sampah.
Ketika awal membuka Akshar Foundation, Parmita dan Mizan mengalami kesulitan. Sebagian besar orangtua tidak mau memasukkan anak-anak mereka ke sekolah. Penyebabnya adalah karena mereka tidak punya biaya untuk membayar uang sekolah anaknya. Para orang tua memilih mengajak anaknya untuk bekerja di pertambangan. Namun Parmita dan Mizan tak patah semangat. Mereka mempunyai satu misi ingin memberikan pendidikan bagi anak-anak dari keluarga kurang mampu.
Parmita dan Mizan pun akhirnya memulai program sekolah gratis untuk semua anak. Lebih tepatnya bukan gratis, melainkan mengganti uang sekolah dengan sampah plastik. Akshar Foundation mewajibkan para siswanya untuk mengumpulkan dan membawa sampah plastik ke sekolah. Program tersebut berawal ketika mereka menyadari ada masalah sosial dan ekologi di lingkungan sekolah mereka.
Gerakan yang dilakukan Parmita dan Mazin mendapat apresiasi dari banyak pihak. Wakil Presiden Akshar, Priyongsu Borthakur, mengatakan bahwa ide mereka sangat mengesankan dan sangat berjasa. Dukungan dalam bentuk lain adalah menjadi banyak anak yang mendaftar di Akshar Foundation. Sekolah yang bermula dengan 20 siswa tersebut kini sudah memiliki hampir 100 siswa yang berusia antara 4 - 15 tahun.
(Sumber: Liputan6.com, dengan penyesuaian)
Cerita di atas sangat inspiratif karena mengisahkan ...
Bahasa Indonesia
Level 9
Menulis
Cerita Inspiratif
Menulis Cerita Inspiratif
Cek Contoh Kuis Online
Kejar Kuis
Cek Contoh Bank Soal
Kejar Soal
Read the text carefully.
PANCAKES
Serve with a little caster sugar or lemon juice.
This recipe is for 2 adults and 2 kids.
Preparation time: 10 minutes
Cooking time: 15 minutes
Ingredients:
- 225 g of plain flour
- 1 egg
- 425 ml of low-fat milk
- Pinch of salt if desired
Methods:
- Sieve the flour and salt into a bowl
- Make a hoe in the center of the flour and drop in the egg with ¼ of the milk.
- Stir the egg mixture in the center of the bowl with a wooden spoon, allowing the flour to fall in gradually from the sides.
- Add the rest of the milk slowly, beating well avoid lumps.
- Pour a thin layer of the mixture onto a hot, non-stick pan.
- Use a spatula to turn the pancake over when bubbles start to appear on top.
Savory Fillings
- Chopped cooked chicken
- Smoked haddock
- Tinned salmon
- Mushrooms
- Mince cooked in curry sauce
- Bolognese sauce
Sweet Fillings
- Jam
- Stewed fruit
- Fried bananas
Source: 101 Square Meals by Safe Food
The recipe can be served for ... people.
Observe the classroom reward chart below and answer the question.
Source: canva.com
Which of the following information is NOT stated on the chart?
Cermati Teks Berikut!
Zat-zat makanan disebut juga gizi atau nutrisi. Makanan bergizi adalah makanan yang mengandung karbohidrat, protein, lemak (lipid), vitamin, dan mineral dalam jumlah yang mencukupi kebutuhan tubuh. Karbohidrat, protein, lemak diperlukan oleh tubuh dalam jumlah banyak sehingga disebut makronutrien. Sementara itu, vitamin dan mineral diperlukan oleh tubuh dalam jumlah yang sedikit sehingga disebut mikronutrien.
Karbohidrat berasal paling banyak pada tumbuh-tumbuhan yang melakukan fotosintesis. Karbohidrat dalam makanan berupa pati, sukrosa, laktosa, dan fruktosa. Lemak tersusun dari atom karbon, hidrogen, dan oksigen. Lemak terdiri atas gliserol dengan asam-asam lemak. Daging dan berbagai produk olahan susu mengandung asam lemak jenuh, sedangkan biji tanaman mengandung asam lemak tak jenuh. Protein tersusun dari atom karbon, hidrogen, oksigen, dan nitrogen. Pada beberapa jenis protein terdapat unsur-unsur mineral sulfur, fosfor, iodin, besi, dan kobalt. Sumber protein berasal dari daging berwarna merah, ikan, telur, susu, kerang, keju, dan kacang-kacangan.
(Sumber: academia.edu-Laporan Uji Zat Makanan, dengan penyesuaian)
Berdasarkan isinya, kutipan tersebut termasuk unsur teks laporan percobaan pada bagian ....
Hasil dari adalah...
Sekolah Berdasarkan Sistem Zonasi, Setuju atau Tidak?
Ketua DPP PKS, Ledia Hanifah Amaliah, memberikan solusi kepada pemerintah terkait penentangan sistem zonasi. Hanifah mengatakan, "Solusi pertama, evaluasi menyeluruh kebijakan sistem zonasi. Kedua, beri keleluasaan pada daerah untuk menyesuaikan kondisinya."
Berdasarkan kutipan teks diskusi di atas, bagian isu yang tepat untuk melengkapinya adalah ...
Langkah-Langkah Percobaan Membuat Tinta Tidak Terlihat
(1) Peras jus lemon ke dalam mangkuk dan tambahkan beberapa tetes air ke dalam mangkuk tersebut.
(2) Tunggu jus tersebut kering sehingga tidak terlihat.
(3) Untuk membaca pesan tersebut dapat dilakukan dengan memanaskan kertas yang dipegang dengan mendekatkannya ke bola lampu.
(4) Kemudian aduk air dan jus lemon dengan menggunakan sendok.
(5) Celupkan cotton bud ke dalam campuran dan tulis pesan di atas kertas putih.
Urutan langkah-langkah percobaan tersebut yang benar adalah ...
Read the message for Diffa sent by Lina below and answer the question.
Template: canva.com
Which of the following expressions is not an expression of wishes and prayers?
Baca teks berikut ini dengan cermat.
Pemerintah Daerah Istimewa Yogyakarta berencana menerapkan konsep Malioboro bebas kendaraan bermotor. Konsep tata wilayah tersebut dimaksudkan untuk membuat kawasan Malioboro menjadi rapi dan tertib sehingga para pengunjung dan pedagang merasa lebih nyaman. Namun yang terjadi justru sebagian pedagang bukannya mendukung program tersebut, ... menolaknya. Mereka khawatir dagangannya menjadi sepi pembeli.
Konjungsi yang tepat untuk mengisi bagian yang rumpang pada teks di atas yaitu ....
Baca teks berikut ini dengan cermat.
Seorang remaja asal Thailand yang tinggal di timur laut Provinsi Kalasin sedang menjadi buah bibir. Remaja tersebut menjadi buah bibir lantaran menjual lukisannya, mayoritas bergambar pemadangan desa, untuk memenuhi tanggungan biaya kuliahnya.
Remaja bernama Krittamet Saisaen, atau yang akrab disapa Earth tersebut bercita-cita menjadi seorang arsitek. Remaja berusia 18 tahun tersebut mengenang kesukaanya melukis pertama kali, yaitu ketika menemani ibunya saat dirawat di rumah sakit. Hobi menggambarnya memang sudah dimulai sejak ia masih kecil. Oleh karena itu, ia sangat berkeinginan menjadi seorang arsitek yang ahli mendesain bangunan.
Earth ingin mendaftar kuliah di Arsom Silp Institute of The Arts, Bangkok. Namun, biaya yang harus ia bayar untuk bisa menempuh kuliah di sana sebesar 60 ribu baht atau lebih dari 27 juta untuk satu semesternya. Untuk meraih gelar sarjana, ia harus menyelesaikan 10 semester atau memerlukan biaya sekitar 270 juta. Biaya kuliah yang sangat tinggi tersebut tak mampu ia penuhi. Apalagi orangtua Earth sudah tidak ada. Ibunya telah meninggal dunia dan ayahnya meninggalkannya beserta adiknya.
Earth tak patah semangat. Ia berharap bisa mendapatkan uang dengan menjual lukisannya. Ia menjual lukisannya kepada tetangga dengan harga 20 sampai 50 baht, atau sekitar 10 ribu sampai 23 ribu rupiah. Meskipun dibayar sedikit, ia tak patah semangat. Ia terus memoles keterampilannya lewat guru seninya dan video tutorial di Youtube.
Kehidupan Earth membaik setelah kisahnya tersebar di berbagai media sosial. Akibat hal tersebut, ia kemudian kebanjiran pesanan membuat lukisan. Pesanan lukisan tersebut dibayar dengan harga 1000 sampai 2000 bath.
Kerja keras Earth mengasah keterampilan dan gigih menjual lukisan akhirnya menuai hasil. Earth menjadi bukti sebagai anak muda yang berjuang meraih cita-citanya meskipun banyak halangan. Dari penghasilan yang ia dapatkan tersebut ia juga bercita-cita membangun pondok ramah lingkungan untuk mengajari anak-anak melukis.
(Sumber: Liputan6.com, dengan penyesuaian)
Gagasan pokok paragraf ketiga cerita inspiratif di atas adalah ...
Baca teks berikut ini dengan cermat.
Bukan Uang, Sekolah Ini Minta Siswanya Bayar Pakai Sampah Plastik
Selama ini, plastik selalu dipandang sebagai masalah dan limbah yang mengotori lingkungan. Sebenarnya sampah juga mempunyai nilai guna apabila dilakukan daur ulang. Bahkan bagi sebagian orang sampah adalah barang yang berharga dan menjadi tumpuan hidup. Sebagaimana sebuah sekolah di India yang menggunakan sampah plastik sebagai pengganti uang sekolah yang harus dibayar oleh siswa.
Akshar Foundation adalah sekolah yang menerapkan program penerimaan limbah plastik untuk didaur ulang. Sekolah yang berada di Desa Pamohi, Guwahati, India tersebut didirikan oleh Parmita Sharma dan Mazin Mukthar. Program daur ulang limbah yang sekolah mereka terapkan juga mengajak siswa terlibat dalam pengumpulan dan pemisahan sampah.
Ketika awal membuka Akshar Foundation, Parmita dan Mizan mengalami kesulitan. Sebagian besar orangtua tidak mau memasukkan anak-anak mereka ke sekolah. Penyebabnya adalah karena mereka tidak punya biaya untuk membayar uang sekolah anaknya. Para orang tua memilih mengajak anaknya untuk bekerja di pertambangan. Namun Parmita dan Mizan tak patah semangat. Mereka mempunyai satu misi ingin memberikan pendidikan bagi anak-anak dari keluarga kurang mampu.
Parmita dan Mizan pun akhirnya memulai program sekolah gratis untuk semua anak. Lebih tepatnya bukan gratis, melainkan mengganti uang sekolah dengan sampah plastik. Akshar Foundation mewajibkan para siswanya untuk mengumpulkan dan membawa sampah plastik ke sekolah. Program tersebut berawal ketika mereka menyadari ada masalah sosial dan ekologi di lingkungan sekolah mereka.
Gerakan yang dilakukan Parmita dan Mazin mendapat apresiasi dari banyak pihak. Wakil Presiden Akshar, Priyongsu Borthakur, mengatakan bahwa ide mereka sangat mengesankan dan sangat berjasa. Dukungan dalam bentuk lain adalah menjadi banyak anak yang mendaftar di Akshar Foundation. Sekolah yang bermula dengan 20 siswa tersebut kini sudah memiliki hampir 100 siswa yang berusia antara 4 - 15 tahun.
(Sumber: Liputan6.com, dengan penyesuaian)
Cerita di atas sangat inspiratif karena mengisahkan ...